- 新型コロナウイルス 感染症(COVID-19)の診断では、RT-PCR法やLAMP法などの遺伝子検査法を用いることが標準法である。
- 日本および米国で抗原検査法の試薬が承認され、COVID-19を迅速に診断することが可能となった。
- しかし採取した検体にある程度のウイルス量がないと抗原検査では検出できない。このため遺伝子検査法よりも偽陰性が多いと予想される。また非COVID-19症例における偽陽性は、まだ検討されていない。
- 抗原検査は、COVID-19を疑う症状があるなど、十分なウイルス量があると考えられる症例を対象として、実施する必要がある。また感染性のある検体を取り扱うため、現時点では、インフルエンザウイルス抗原検査のように外来では実施できないという問題点もある。
はじめに
新型コロナウイルス(SARS-CoV-2)感染症(COVID-19)では、発症早期に一般的なウイルス性上気道感染症と区別することは難しい。確定診断のためにはRT-PCR法やLAMP法などの遺伝子検査によって、SARS-CoV-2の存在を証明することが必要となる。
しかし遺伝子検査法の実施体制の整備には、さまざまな課題がある[1]。
現時点では、遺伝子検査法は迅速性の点でも問題がある。そこで、インフルエンザウイルスやRSウイルスなどと同様に、迅速かつ簡易に検査できる抗原検査の活用が望まれている。ここでは厚生労働省の「SARS-CoV-2抗原検出キットの活用に関するガイドライン」[2]および日本臨床検査医学会の「COVID-19抗原検査についての基本的な考え方」[3]の内容を中心に、抗原検査法の現状とその課題について述べる。
抗原検査法の現状
米国では、Quidel CorporationのSofia 2 SARS Antigen FIA testが、米国食品医薬品局(FDA)から最初の抗原検査法として、緊急使用許可(EUA)を取得した。
FDAの声明では、抗原検査法の迅速性がメリットであるとされているが、RT-PCRほどの感度はないとされている。EUAを取得した抗原検査の試薬については、Clinical Laboratory Improvement Amendments (CLIA)で一定レベル以上に認定された検査室で使用可能とされ[4]、実施できる検査室に制限がある。また、この試薬のファクトシートでは、抗原検査で陰性であっても、COVID-19を否定できないと記載されている[5]。
日本では、5月13日に富士レビオのエスプライン®︎SARS-CoV-2が体外診断用医薬品として初めて認可された。この試薬では5~10分程度の前処理後に約30分で結果を判定することが可能であり[6]、遺伝子検査法よりも迅速にCOVID-19の診断ができる。臨床検体および行政検査検体を用いたRT-PCR法との試験成績を【図表1, 2】に示す。これらの結果から、抗原検査は一定のウイルス量(コピー数)がある検体であれば検出率が高いが、ウイルス量が少ない検体では検出率が低いと考えられる。
| 図表1 |
| 臨床検体での抗原検査の試験成績 |
 |
| [2][6]のデータから作成 |
| 図表2 |
| 行政検査検体での抗原検査の試験成績 |
| スワブがウイルス輸送液に浸された試料液を使用したもの。 |
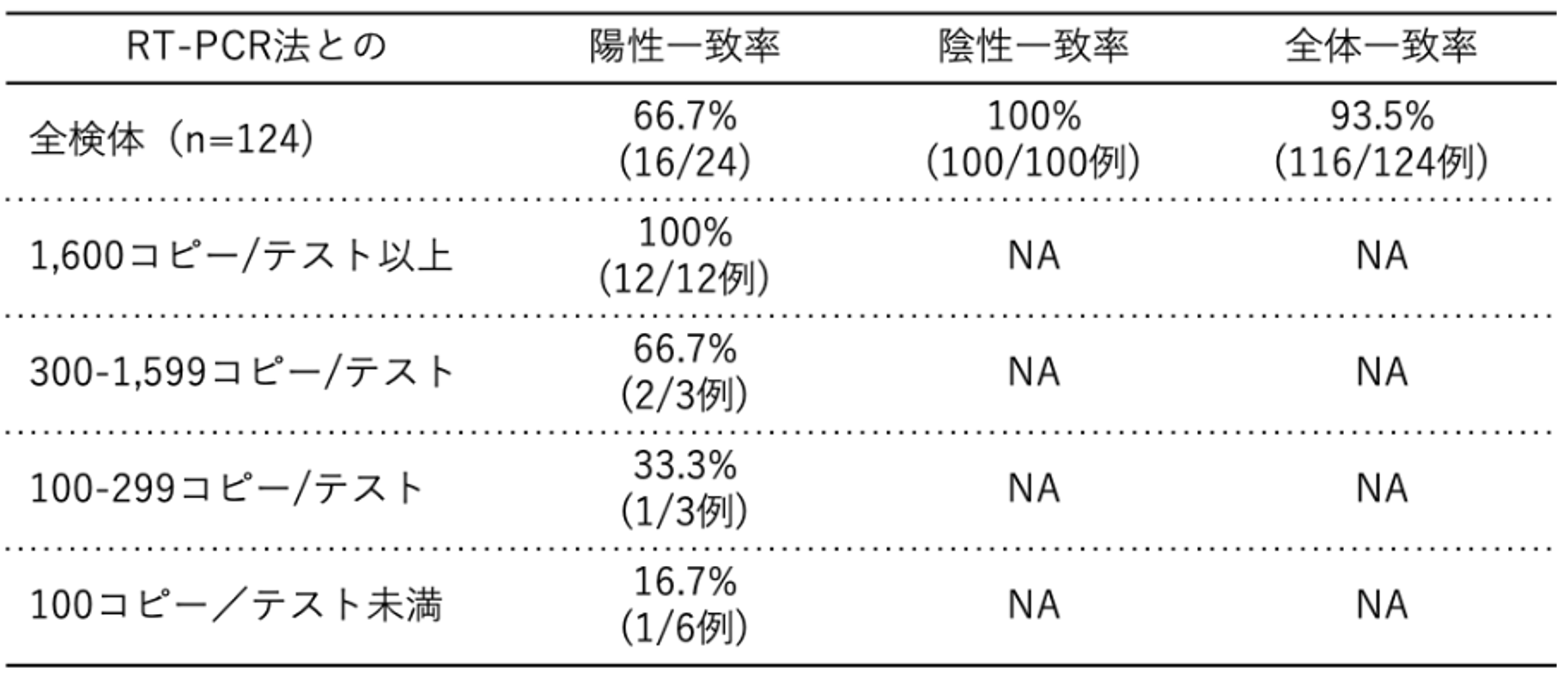 |
| [2][6]のデータから作成 |
抗原検査の課題
抗原検査の課題は、ウイルスのコピー数が少ない検体での検出率の低さ、すなわち検出感度が低いということである。そのため、厚労省のガイドラインでは「医師がCOVID-19を疑う症状があると判断した者に対して、必要性を認めた時に使用する」とされている[2]。
エスプライン®︎SARS-CoV-2においても、「本品の陰性判定は、非感染の確定診断には使用できず、確定診断 のためには核酸検査等の追加試験の実施が必要」と明記されている[6]。そのため、現段階においては、COVID-19が疑われる症例で使用することと、疑い症例で判定が陰性であった場合には、RT-PCRなど他の検査で確認することが重要であり、陰性確認のために抗原を用いることは推奨されない[3]。
抗原検査のもう1つの課題は、感染性のある検体の取り扱いである。抗原検査では鼻咽頭ぬぐい液の採取が必要となるため、採取する医療従事者および他の患者への感染予防が徹底された環境で行う必要がある[3,7]。
抗原検査の実施で検体の処理液が飛散する可能性もあるため、実施者の感染予防のためにBSL2以上の検査室で安全キャビネットを使用して操作することも必要となる[3]。そのため、インフルエンザウイルスの抗原検査と同じように、外来で実施することはまだ難しい。
おわりに
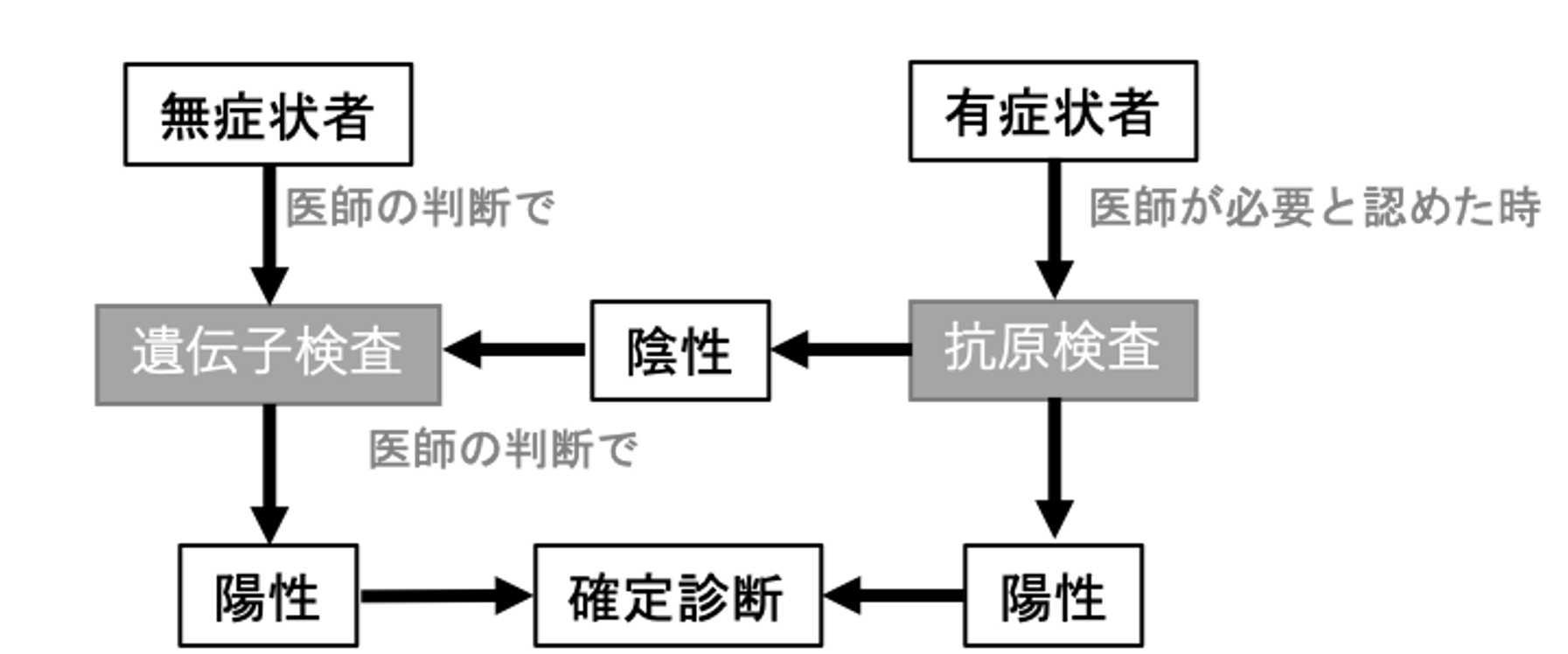
COVID-19の診療における抗原検査を【図表3】に示す。検出感度や検体の取り扱いなどの課題から対象となる症例を限定して実施する必要があるが、その迅速性からCOVID-19の診療でも活用できる可能性がある[2]。試薬の改良や開発が進み前述した課題が解決されれば、多くの症例で使用できるようになると考えられる。
| 図表3 |
| COVID-19の診療における抗原検査の位置付け |
 |
[引用文献]
- 宮地 勇人. 新型コロナウイルス 検査の俯瞰:PCR検査の現場課題と対応を中心に. 日本医師会COVID-19有識者会議ホームページ. https://www.covid19-jma-medical-expert-meeting.jp/topic/75 (閲覧日2020年6月4日)
- 厚生労働省新型コロナウイルス感染症対策本部. SARS-CoV-2抗原検出用キットの活用に関するガイドライン. https://www.mhlw.go.jp/content/000630270.pdf (閲覧日2020年6月4日)
- 日本臨床検査医学会・新型コロナウイルスに関するアドホック委員会. COVID-19抗原検査についての基本的な考え方 2020年5月26日(第1版). https://www.jslm.org/committees/COVID-19/20200526.pdf (閲覧日2020年6月4日)
- The U.S. Food and Drug Administration. Coronavirus (COVID-19) Update: FDA Authorizes First Antigen Test to Help in the Rapid Detection of the Virus that Causes COVID-19 in Patients. https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-first-antigen-test-help-rapid-detection-virus-causes (閲覧日2020年6月4日).
- Quidel Corporation. Fact sheet for healthcare providers Sofia 2 SARS Antigen FIA – Quidel Corporation. https://www.fda.gov/media/137884/download (閲覧日2020年6月4日).
- 富士レビオ株式会社. エプスラインSARS-CoV-2添付文書. https://www.info.pmda.go.jp/tgo/pack/30200EZX00026000_A_01_03/ (閲覧日2020年6月4日).
- 国立感染症研究所、国立国際医療研究センター国際感染症センター. 新型コロナウイルス感染症に対する感染管理 改訂2020年6月2日. https://www.niid.go.jp/niid/images/epi/corona/2019nCoV-01-200602.pdf (閲覧日2020年6月4日).