- SARS-CoV-2の気道系への感染には、気道上皮細胞の細胞膜表面にあるACE2(Angiotensin converting enzyme2)とTMPRSS2(Transmembrane protease, serine 2)の2つの受容体が必須となる。ACE2受容体は年齢とともに増加し、男性でより多く、運動や喫煙によっても増加する。
- 喫煙によりACE2発現は増加するため、COPD患者ではACE2発現は増加している。COPD患者はCOVID-19に罹患しやすく、いったん罹患すると重症化しやすいことが知られているが、これはACE2の発現と相関している。
- 喘息患者では健常者と比較し、ACE2、TMPRSS2の発現は高くない。特にアトピー要因が強い症例や喘息コントロールが不良な患者では、逆にACE2は低い傾向を示す。このことから、喘息患者はCOVID-19に罹患しやすくないことが推測される。
- 疫学的にも、喘息患者はCOVID-19に罹患しづらく、COVID-19の重症化因子とはならないことが明らかにされつつある。
- 国内外の関連学会はCOVID-19蔓延期における気管支喘息治療に関して、未だ明確なエビデンスに欠けるため成人重症喘息患者では生物学的製剤を含めて通常の治療を継続することを推奨している。
はじめに
SARS-CoV-2などのコロナウイルスは、脂質二重層と外膜タンパク質からなるエンベロープ(外膜)でウイルスゲノムRNAが囲まれている。SARS-CoV-2はエンベロープに存在するSpikeタンパク質(Sタンパク質)が細胞膜の受容体、ACE2(Angiotensin converting enzyme2)に結合したあと、ヒトの細胞への侵入を開始する。Sタンパク質はヒト細胞由来のプロテアーゼによりS1とS2に切断される。その後S1が受容体であるACE2に結合する。もう一方の断片S2はヒト細胞表面のセリンプロテアーゼであるTMPRSS2(Transmembrane protease, serine 2)で切断され、その結果膜融合が進行する。ACE2とTMPRSS2の遺伝子発現は、組織細胞の種類によって異なっており、それには個人差や性差もある。ACE2は、肺、心臓、小腸、腎臓、精巣、肝臓の上皮細胞に、TMPRSS2も肺、腎臓、小腸、精巣などで幅広く発現している。HoffmannらによるとSARS-CoV-2の感染にはACE2とTMPRSS2が気道上皮細胞において発現していることが必須とされている[1]。
ACE2の発現量は、年齢、性別、ライフスタイルによって変わるとされている。細胞表面にあるACE2は年齢とともに増加し、一般的に女性よりも男性のほうがその密度が高い傾向がある。また、ACE2の発現量は、運動や喫煙によっても増加するとされている。腎臓はACE2とTMPRSS2の発現量が多い。新型コロナ感染症時の急性腎不全の報告は多いが、呼吸器系以外で新型コロナウイルスが腎臓などの臓器に直接感染するかどうかは、いまのところ明確なエビデンスはない。
ACE2の発現量は、正常人のSARS-CoV-2への罹患しやすさと相関するが、喫煙との関連で考えると呼吸器疾患を合併している患者での重症化との関連も注目される。COVID-19では、高血圧、糖尿病、循環器疾患(心不全、脳卒中、狭心症、心筋梗塞)、慢性腎臓病、悪性疾患(特に化学療法、放射線治療中)などの合併が重症化リスクとなるが、喫煙、慢性肺疾患も同様に重症化リスクとなる。
ACE2受容体と呼吸器疾患
喫煙はACE2の発現は有意に増加させるため、わが国ではその原因の90%が喫煙とされるCOPD(慢性閉塞性肺疾患)の患者では、その気道上皮すなわち、気管から細気管支領域のみならず肺胞においてもACE2の発現は増加していることが報告されている[2]。これは、現喫煙者のみならず 既喫煙者でも同様であり、COPD患者においては気流制限が進行し重症度が上がるとともにACE2発現量が増加することが示されている。疫学的にCOPD患者はCOVID-19に罹患しやすく、いったん罹患すると重症化しやすいことが知られているが、これはACE2の発現と相関している[3]。
呼吸器疾患の中ではCOPD以外では、特発性間質性肺炎(IPF)でもACE2発現が増えることが報告されている[4]。間質性肺炎の中では、IPF、特に肥満を伴うIPFで有意に死亡リスクが高いことが報告されており、これもACE2発現と密接に関連するものと推察される。一方、サルコイドーシス患者ではACE2発現は少ない傾向にあることが示されている。
気管支喘息とACE2・TMPRSS2受容体
PetersらはSARP-3(米国重症喘息プログラム)にエントリーされた330名の患者の喀痰中のこれらの受容体の発現に関して検討を行い、喘息患者と健常者でACE2、TMPRSS2の発現に差は認めないことを報告している[5]。サブ解析では、喘息患者の中では、高齢者、男性、アフリカ系でACE2が有意に多いことが示されている。さらには、ICS(吸入ステロイド薬)使用量でサブグループ化すると、高用量使用者でACE2、TMPRSS2は有意に低いことも示している。
一方、Jacksonらは小児喘息患者の鼻腔粘膜を検討し、喘息患者のうちIgE高値でアトピー要素の強い患者ではACE2発現は有意に低値となることを報告している[6]。また同時にin vivoでの気管支アレルギー誘発試験、in vitroでのIL-13添加後にはACE2発現は有意に減少することを示している。
さらにKimuraらはアレルギー性鼻炎患者の鼻腔粘膜を検討し、コントロール良好な喘息患者より不良な患者、Th2炎症がより強い患者で、ACE2の発現が有意に低いことを報告している[7]。
以上をまとめると、喘息患者では健常者と比較し、ACE2、TMPRSS2の発現は高くない。特にアトピー要因が強い症例や、高用量ICS使用者であったり喘息コントロールが不良な患者では、逆にACE2は低い傾向を示す。このことから、喘息患者はCOVID-19に罹患しやすくないことが推測される。
気管支喘息とCOVID-19:疫学的検討
喘息患者では健常者と比べウイルス感染時のIFN-α産生能が低下するなど抗ウイルス免疫応答が不十分なことから、一般的に呼吸器系ウイルス感染により症状が増悪する。症状増悪をきたすウイルスとしてライノウイルスやRSウイルスが有名だが、一般的なヒトコロナウイルス(4種類)も増悪の原因としては全体の10%程度と非常に多いことが知られている。このことを踏まえると、理論的には喘息患者はCOV-19に感染しやすく、重症化しやすいと考えられる。しかしながら同じコロナウイルスであるSARSやMERSについても、喘息増悪の報告はほとんどない[8]。
松本らは中国、米国、メキシコで行われた8つの観察研究の統合解析から、COVID-19患者の喘息合併率は5.3%であり、各地域の喘息有病率(平均8.0%)よりも低く、喘息患者はCOVID-19に罹患しづらいことを示した[9]。
ニューヨークの2施設に入院した患者を対象とした後ろ向きコホート研究では、喘息合併率はCOVID-19非重症例(12.2%)と重症例(13.1%)で有意な差を認めなかった【表1】。この研究を含めた統合解析でも、松本らはCOPD、糖尿病の合併率はCOVID-19非重症例に比べ重症例で高いが、喘息合併率には差が見られないとする結果を報告している[9]。以上より、喘息はCOPDとは異なり、COVID-19の重症化因子とは言えないと考えられる。
Chhibaらは、コンピュータアルゴリズムを用いてPCRでCOVID-19が確認された米国の患者の医療記録を検索し、喘息・ICS使用と入院リスクとの関連についてメタ解析を行った[10]。COVID-19患者1,526人のうち220人(14.4%)が喘息を罹患していたが、年齢、性別、併存疾患を調整したモデルで、喘息は入院リスクの増加との関連は認められなかった。ICS使用についても同様の結果が示されている。
| 表1 |
| COVID-19感染者のうち喘息患者が占める割合の統合解析 |
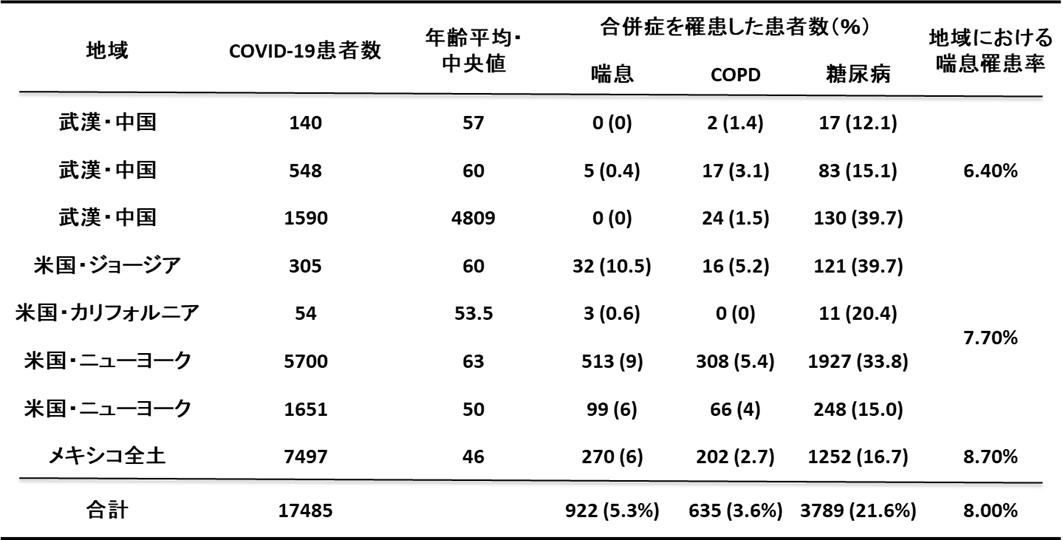 |
| [9]より引用改変 |
COVID-19蔓延期における気管支喘息治療:国内外の関連学会が提示する見解
日本アレルギー学会は、喘息患者がCOVID-19に罹患した場合の対応について、「喘息治療の差し控えは喘息発作およびその重症化を来す危険性が高いため、通常の治療を継続すること。ただし経口ステロイド薬についてはウイルス感染の遷延や二次的細菌感染症などのリスク因子となりうるため、必要最小限に止めるべき」「アスピリン喘息患者では非ステロイド性抗炎症薬使用で急性増悪が誘発されるため、解熱鎮痛薬を使用する際にはアスピリン喘息の既往を必ず確認する」ことなどを勧告している。
また、日本喘息学会は、COVID-19流行期にはウイルスをエアロゾル化して感染伝播させる可能性のあるネブライザーは使用しないよう注意喚起している。喘息発作治療として、加圧式定量噴霧吸入器(+スペーサー)を用いた短時間作用型β2刺激薬の使用を推奨している。エアルゾル中での新型コロナウイルス(SARS-CoV-2)の感染性は16時間保持されたとする報告などの基づいて行われた勧告であるが、エビデンスグレードは低く、今後の報告次第では、対応が変わる可能性も残されている。
成人重症喘息患者では生物学的製剤による分子標的治療も選択肢となる。COVID-19患者ではIL-4は増加または不変、IL-5は不変、IL-13は増加するなど、サイトカインに変化が生じることが報告されており、その使用の可否について議論が交わされてきた。最近になり、抗IgE抗体オマリズマブや抗IL-5受容体抗体ベンラリズマブ、抗IL-4α受容体抗体デュピルマブで治療中の重症喘息患者がCOVID-19に罹患したものの、喘息の増悪や肺炎を来すことなくウイルス陰性化まで経過した症例報告が散見されている。これらを踏まえると、生物学的製剤を使用中の喘息患者がCOVID-19に罹患した場合、あえて止める必要はないと考える。なお、重症喘息患者の生物学的製剤の使用について、米国アレルギー・喘息・免疫学会(AAAAI)と世界アレルギー機構(WAO)は「同薬がCOVID-19に有害だというデータはなく、中止による喘息コントロールの悪化が懸念される」といった理由で、COVID-19流行期も継続することを推奨している。
喘息治療の基本となるICS(吸入ステロイド薬)に関して、本年(2020年)5月に報告されたシステマチックレビューではICSの使用がCOVID-19の転帰に有害か有益かのエビデンスは現段階で存在しないとしている[11]。Schultzeらの観察研究では、喘息コホート(818,490人)ではICS vs SABA(短時間作用性β2刺激薬)、COPDコホート(148,557人)ではICSを含む製剤 vs LAMA/LABA(長時間作用性抗コリン薬、β2刺激薬)で死亡リスクを検討している[12]。COPDコホートではICS群でCOVID-19関連死のリスクが有意に上昇したが、喘息コホートでは高用量ICSで死亡リスクが高かったが、低用量および中用量ICSでは差がなかった。Sensitivity analysesの結果、ICSに有害作用があるわけではなく、バースラインでの疾患の重症度で説明がつくと結論づけている。ICSのCOVID-19患者に対する効果については、今後の知見の集積が待たれるところである。
なお、ICSについてはわが国では日本感染症学会の主導で、SARS-CoV-2に対する抗ウイルス作用が見いだされているシクレソニドの投与観察研究が進められている。あわせて国立国際医療研究センター病院を中心にCOVID-19の無症状・軽症患者に対する同薬の有効性と安全性を検討する多施設共同非盲検ランダム化試験も進行中である。
[引用文献]
- Hoffmann et al. Cell 2020; 181, 1-10.
- Leung J t al Eur Respir J 2020; 55: 2000688.
- Zhao Q, et al. J Med Virol. 2020. PMID: 32293753
- Smith J et al. Developmental Cell 2020; https://doi.org/10.1016/j.devcel.2020.05.012.
- Peters MC et al. Am J Respir Care Crit Med 2020. 10.1164/rccm.202003-0821OC.
- Jackson DJ et al. J Allergy Clin Immunol 2020. doi.org/10.1016/j.jaci.2020.04.009
- Kimura H et al. J Allergy Clin Immunol 2020. doi: https://doi.org/10.1016/j.jaci.2020.05.004
- Van Bever HP et al. Pediatr Allergy Immunol 2004; 15(3):206–209.
- Matsumoto K et al. J Allergy Clin Immunol 2020; 146: 55–57.
- Chhiba KD et al. J Allergy Clin Immunol. 2020; 146: 307-14.
- Halpin D et al. Eur Respir J 2020; 55: 2001009.
- Schultze A et al. Lancet Respir Med 2020 ; doi.org/10.1016/S2213-2600(20)30415.