注:この記事は、有識者個人の意見です。COVID-19有識者会議の見解ではないことに留意ください。
- COVID-19の治療法開発には多くの研究者と企業が総力をあげてこの一年取り組んできた。本稿では、本邦で治療薬として承認されている抗ウイルス薬のレムデシビルと、抗炎症薬であるデキサメタゾン、バリシチニブの3剤に加え、開発中又は開発予定のある医薬品につき、現時点での薬剤開発の状況について概説する。
- レムデシビルは、ACTT-1試験の中間解析の結果等をもとに、2020年5月7日に特例承認された。ただし、本剤投与時には医療機関から厚生労働省に依頼し、薬剤提供を受けることとなっており、現時点では重症患者に薬剤提供が限定されている状況である。
- デキサメタゾンは、オックスフォード大学主導で英国にて実施中の試験にて、標準治療群とデキサメタゾンを一日6 mg最大10日間投与する群とで28日までの死亡率を比較した結果が公表され、この試験成績を受けて、厚生労働省は2020年7月21日に、レムデシビルに引き続きデキサメタゾンを日本国内で承認されている医薬品として追加した。
- バリシチニブは、企業主導の国際共同二重盲検プラセボ対照RCTの他、RDV併用下での本剤の有効性及び安全性を評価する国際共同プラセボ対照二重盲検RCTがNIAID主導で実施され、本試験結果を元に、本邦ではSARS-CoV-2による肺炎に対して2021年4月23日に承認された。なお、本剤の投与はレムデシビル併用の上、酸素吸入、人工呼吸管理又はECMO導入を要する患者を対象に入院下で投与を行うこと、また、副作用に静脈血栓塞栓症の報告があることから、本剤投与時は原則抗凝固薬の投与等による血栓塞栓予防を行う旨、添付文書にて注意喚起されている。
- 開発中の新規薬剤では、SARS-CoV-2の生活環の中で必須の酵素を標的とした製剤が3種類あり、その成否に注目が集まっている。また感染回復者から、SARS-Cov-2の中和抗体を同定・分離し、新規抗ウイルス薬として開発する試みも進行中である。
- COVID-19のような新興感染症では、発生時点では治療薬は存在しないことが多い。既存薬や他効能で開発中の医薬品の中からの有効薬剤の探索は、新薬開発の大きな壁である「安全性」がある程度担保できていることから、有効なものが見出せれば大きな社会的効果が期待される。ファビピラビル、トリシズマブ、サリルマブといった既存薬が候補として取り上げられ、本邦においても臨床試験が実施されている。
- この一年で多くの試験が行われてきたが、本項執筆時点では承認薬剤は3種類に留まっており、治療薬開発のハードルの高さが認識される。低分子化合物の抗ウイルス剤等がphase III試験にさしかかっていることもあり、優れた治療薬の登場が間近いことを期待する。
はじめに
2019年末に中国で確認後、急速に全世界に拡散した新型コロナウイルス(severe acute respiratory syndrome coronavirus 2:SARS-CoV-2)は、今日に到るまで1億7000万人が感染し350万人が死に到る歴史に残るパンデミックとなっている。このSARS-CoV-2による新型コロナウイルス感染症(coronavirus disease 2019:COVID-19)の治療法開発には多くの研究者と企業が総力をあげてこの一年取り組んできた。抗ウイルス活性が示唆される既存薬のrepositioningの試行に加え、重症例での病態への関与が示唆される過剰免疫の抑制についても各種抗炎症薬の効果を検証する臨床試験が実施されている。しかし、2021年4月時点、本邦でCOVID-19治療薬として承認されているものは、抗ウイルス薬のレムデシビルと、抗炎症薬であるデキサメタゾン、バリシチニブの3剤のみである。
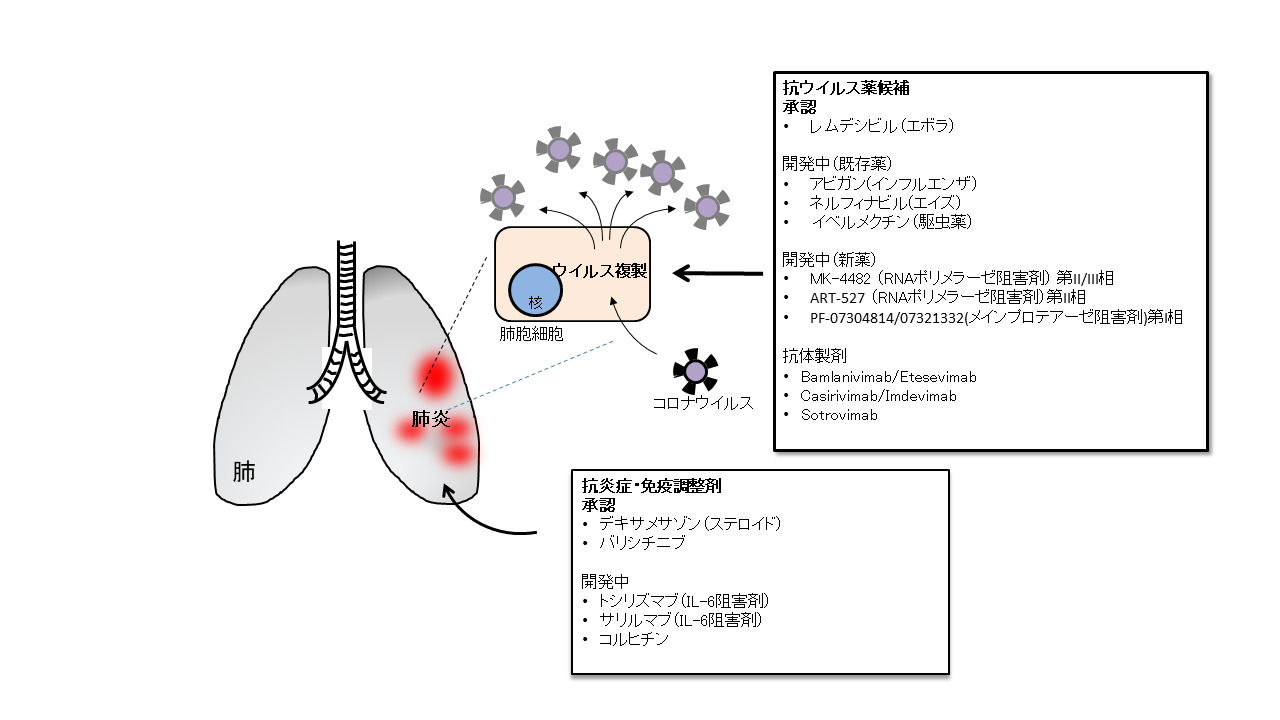
本稿では、本邦での承認薬に加え、開発中又は開発予定のある医薬品につき、COVID-19に関する国内の診療の手引きやNIHの治療ガイドライン等[1]で主要な根拠論文として取り上げられているランダム化比較試験(RCT)の成績等を中心に、現時点での薬剤開発の状況について概説する(表及び【図1】を参照)。
| 図1 |
| COVID-19治療薬開発薬剤と標的 |
| 承認及び開発中のCOVID-19治療薬を作用機序(抗ウイルス作用、抗炎症作用)ごとに示す。 |
 |
Ⅰ. 国内で承認された薬剤【表1】
1) レムデシビル[ベクルリー:ギリヤド・サイエンシズ株式会社]
レムデシビルは、元々はエボラ出血熱に対して開発されたRNAポリメラーゼ阻害薬であり、in vitroの系でSARS-CoV-2に対しても阻害活性が認められたことから[2]、パンデミック初期よりCOVID-19に対する臨床試験が行われた。
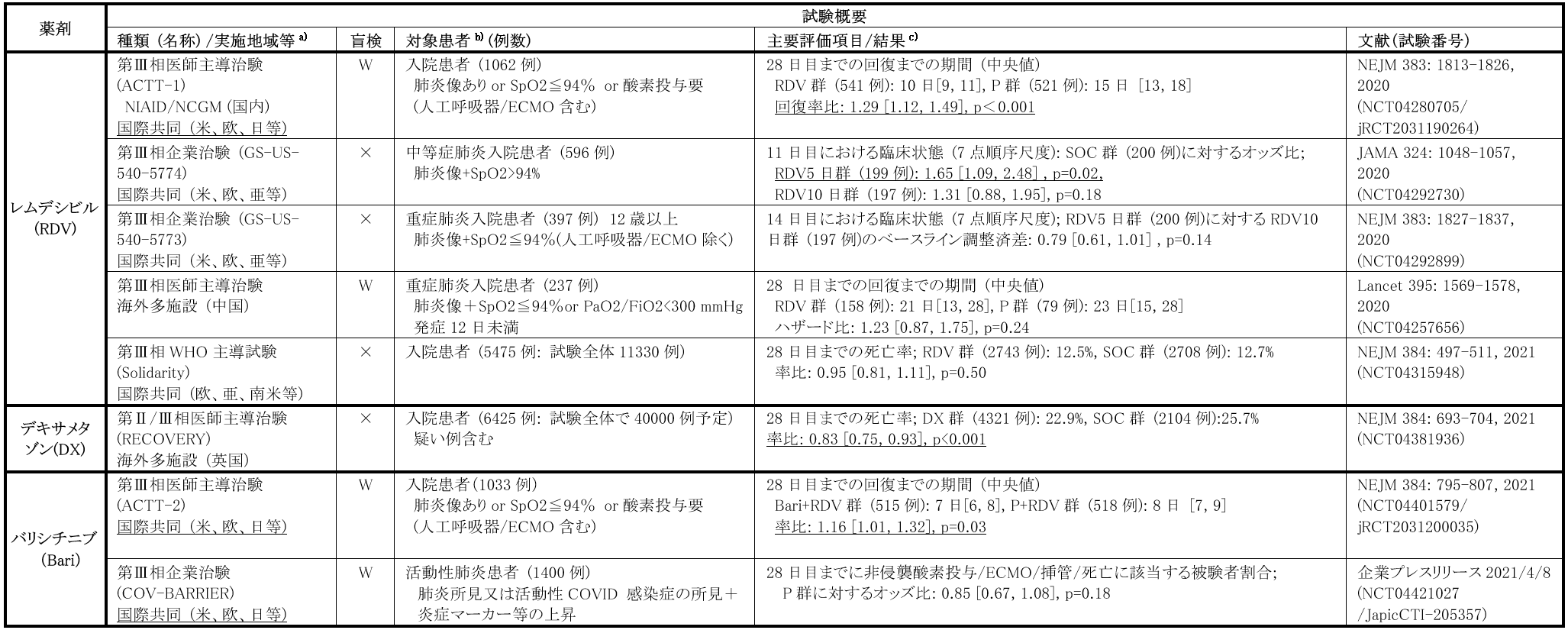
本邦も参加した米国国立衛生研究所アレルギー・感染症研究所(NIAID)が主体となり実施された、中等症~重症相当の成人COVID-19患者1062例を対象とした国際共同プラセボ対照二重盲検RCT(ACTT-1試験)において、回復期間の中央値[95%信頼区間]は、プラセボ群15日[13, 18]に対し本剤群10日[9, 11]であり、本剤群とプラセボ群との対比較において統計学的に有意な差が認められた(ハザード比:1.29[1.12, 1.49]、p<0.001)。また、企業治験として実施された中等症COVID-19患者596例を対象とした非盲検RCT(GS-US-540-5774試験)では、主要評価項目である7点順序尺度で評価した無作為化後10日目の臨床状態について、本剤5日投与群は標準療法群と比較して有意に臨床的改善をもたらすことが示されたものの(オッズ比:1.65[1.09, 2.48]、p=0.02)、本剤10日投与群と標準療法群との間に有意差は認めなかった(オッズ比:1.31[0.88, 1.95]、p=0.18)。
一方、レムデシビルの有効性については否定的な報告も存在する。重症COVID-19患者を対象に中国で実施された多施設共同プラセボ対照二重盲検RCTでは、目標被験者数452例の組み入れを達成できず237例の組み入れで試験を終了した為統計学的な解釈は困難であるものの、臨床状態改善までの時間に両群の差は認められなかった(本剤群21日、プラセボ群23日、ハザード比:1.23[0.87, 1.75])。世界30カ国から入院中COVID-19患者を登録し、レムデシビルを含む複数の薬剤の有効性を評価するWHO主導の非盲検RCT(Solidarity試験)の中間解析の結果も、死亡率、挿管率、入院期間等の有効性評価指標について、各治療群(レムデシビル、ヒドロキシクロロキン、ロピナビル及びインターフェロン1α)と各々の対照群との間に大きな差異を認めなかった。このように、レムデシビルの有効性に関して試験間でのばらつきはあるが、これまでの試験成績や作用機序からは、重症化前の酸素需要のある発症早期例でより高い効果が得られることが想定される。
本邦においては、ACTT-1試験の中間解析の結果等をもとに、2020年5月7日に特例承認された。また、承認条件に基づき提出されたACTT-1試験、GS-US-540-5773/5774試験の最終報告書の試験成績をもとに、2021年1月7日、添付文書が改訂され、「原則として、酸素飽和度94%(室内気)以下、又は酸素吸入を要する、又は体外式膜型人工肺(ECMO)導入、又は侵襲的人工呼吸器管理を要する重症患者」に限定されていた投与対象が、「SARS-CoV-2による肺炎を有する患者」と拡大され、推奨投与期間も、ECMO装着の有無にかかわらず原則5日間(症状の改善が認められない場合は10日目まで投与可)に統一された。ただし、薬剤供給が限られるため、本剤投与時には医療機関から厚生労働省に依頼し、薬剤提供を受けることとなっており、現時点では改訂前の添付文書に記載の重症患者に薬剤提供が限定されている状況である。
2) デキサメタゾン[デカドロン:日医工株式会社他]
副腎皮質ステロイド薬は抗炎症作用、抗アレルギー作用、免疫抑制作用など、広範囲にわたる作用がある。肺感染症に対するステロイド薬の全身投与については、広範な肺組織の炎症・傷害に対しステロイドが保護的に働く可能性を示唆する知見がある一方で、SARSやMERS等ではウイルスのクリアランスを遅延させたとの報告もあり[3][4]、免疫抑制作用に伴う二次感染のリスク増大や長期合併症の問題等含め、一定の見解が得られていない。
デキサメタゾンは合成副腎皮質ステロイド剤の一つであり、抗炎症作用、抗アレルギー作用、免疫抑制作用など、広範囲にわたる作用があり、国内では重症感染症等多岐にわたる適応症を有する既承認薬である。他のステロイドと比較し抗炎症作用が強く半減期が長い特徴があり、ミネラルコルチコイド作用は低い。
COVID-19に対する有効性について、オックスフォード大学主導で英国にて実施中の大規模な非盲検ランダム化アダプティブプラットフォーム試験RECOVERY試験にて、標準治療群(4321例)とデキサメタゾンを一日6 mg(経口又は静脈内投与)、最大10日間投与する群(2104例)とで28日までの死亡率を比較した結果が公表された。全体集団においても、標準治療群25.7%と比較し本剤群22.9%と、本剤投与にて死亡率は有意に低下したが(年齢調整率リスク比 (RR): 0.83[0.75, 0.93]、p<0.001)、酸素投与を要する患者における本剤群及び標準治療群での死亡率は、人工呼吸器使用患者にて29.3%対41.4% (RR: 0.64[0.51, 0.81])、非侵襲的酸素投与患者にて23.3%対26.2% (RR: 0.82[0.72, 0.94])と、本剤の有効性がより明確であった一方、酸素投与の必要のない患者での死亡率は17.8%対14.0%となり、有意差は認められなかった(RR: 1.19[0.91, 1.55])。この試験成績を受けて、厚生労働省は2020年7月21日に、「新型コロナウイルス感染症COVID-19 診療の手引き 第2.2版」を公開し、レムデシビルに引き続きデキサメタゾンを日本国内で承認されている医薬品として追加した。
デキサメタゾン以外のステロイド剤の全身投与については、現時点で明確に有効性を示唆する報告はない。国内では、名古屋大学を中心に、酸素投与を必要とする肺炎合併COVID-19患者69例を対象に、ファピピラビル併用下でメチルプレドニゾロンを投与する非盲検単群試験が特定臨床研究として実施中である(jRCTs041200025)。
3) バリシチニブ[オルミエント:日本イーライリリー株式会社]
炎症性サイトカインによる免疫活性化細胞内シグナル伝達において重要な役割を果たすJAK等のチロシンキナーゼを選択的に阻害する薬剤は、COVID-19重症例における抗炎症効果が期待される薬として着目され、各種試験が実施されている。本邦で承認されているJAK阻害薬は、関節リウマチ(RA)等の適応を有するトファシチニブ、バリシチニブ、ペフィシチニブ、ウパダシチニブ、フィルゴチニブの他、骨髄繊維症及び真性多血症に効能を有するJAK2選択的阻害薬ルキソリチニブの6剤だが、バリシチニブはJAKの4つのサブタイプ(JAK1~3及びTYK2)のうち、主にJAK1/2を選択的に阻害する経口薬であり、本邦ではRA及びアトピー性皮膚炎で適応を取得している。
抗炎症効果に加え、in vitroにてSARS-CoV-2のエンドサイトーシス経路の阻害作用も推測されたことから[5]、企業主導の国際共同二重盲検プラセボ対照RCT(COV-BARRIER試験)の他、入院COVID-19肺炎患者1033例を対象に、RDV併用下での本剤の有効性及び安全性を評価する国際共同プラセボ対照二重盲検RCT (ACTT-2試験)がNIAID主導で実施され、本邦も参加した。回復までの期間の中央値は、本剤群で7[6,8]日、プラセボ群で8[7,9]日であり、プラセボ群に対する本剤群の優越性が検証されたが(ハザード比:1.15[1.00, 1.31]、p=0.047)、この効果は、ベースライン時に酸素投与が必要であった患者にてより顕著であった。
本試験結果を元に、本邦ではSARS-CoV-2による肺炎に対して2021年4月23日承認された。なお、提出された試験成績を踏まえ、本剤の投与はレムデシビル併用の上、酸素吸入、人工呼吸管理又はECMO導入を要する患者を対象に入院下で投与を行うこと、また、本剤の副作用に静脈血栓塞栓症の報告があることから本試験では禁忌のない限りヘパリン投与等の予防措置を行われており、本剤投与時は原則抗凝固薬の投与等による血栓塞栓予防を行う旨添付文書にて注意喚起されており、投与にあたり留意が必要である。また、現時点では抗炎症作用薬のステロイドとJAK阻害薬の位置づけは明らかではなく、NIHガイドラインではステロイドが使用できない場合にのみ、非侵襲的酸素投与中の入院患者に対しレムデシビル併用下に本剤を投与することを推奨するのみにとどまっている。現在、ACTT-2に引き続き、レムデシビル併用下でデキサメタゾン又はバリシチニブいずれかを投与し臨床効果を比較するACTT-4試験(NCT04640168/jRCT2031200252)が実施中であり、その結果が待たれる。
| 表1 |
| 国内承認された治療薬 |
 |
| 略語:W(二重盲検)、S(単盲検)、×(非盲検)、P群:プラセボ群、SOC群:標準治療群、a) 下線は本邦参加あり、b) SpO2は室内気の値、c) [ ]は95%信頼区間、下線は統計学的に有意な結果 |
Ⅱ. 開発中の新規薬剤
A. 低分子化合物【表2-1】
SARS-CoV-2の生活環の中で必須の酵素、RNA依存性RNAポリメラーゼ(RdRP)とメインプロテアーゼを標的とした新規化合物の開発が進んでいる。現在国内で臨床試験に進んでいるものもしくは今後開発の可能性のある製剤が3種類あり、その成否に注目が集まっている。
| 表2-1 |
| 開発が進む新規薬剤(低分子化合物) |
 |
| 略語:W(二重盲検) a) 下線は本邦参加あり |
1) Molnupiravir(MK-4482/EIDD-2081:MSD株式会社)
MK-4482/EIDD-2081はRdRpを標的としたシチジンアナログ製剤EIDD-1931 (b-D-N4-hydroxycytidine)のプロドラッグであり、経口摂取が可能な薬剤である[6]。2000年代初頭にC型肝炎の治療薬として開発が進められて化合物であり、インフルエンザAやRSに対しても阻害活性を示す。EIDD-1931はchain terminatorとして作用するのではなく、シチジンの代わりに転写RNA鎖に取り込まれるとこで嬢RNA鎖に変異を誘導してウイルスを不活化する[7]。その作用機序から宿主のゲノムに対しても催奇形性が危惧されたが、動物実験ではその危険は示されなかった。
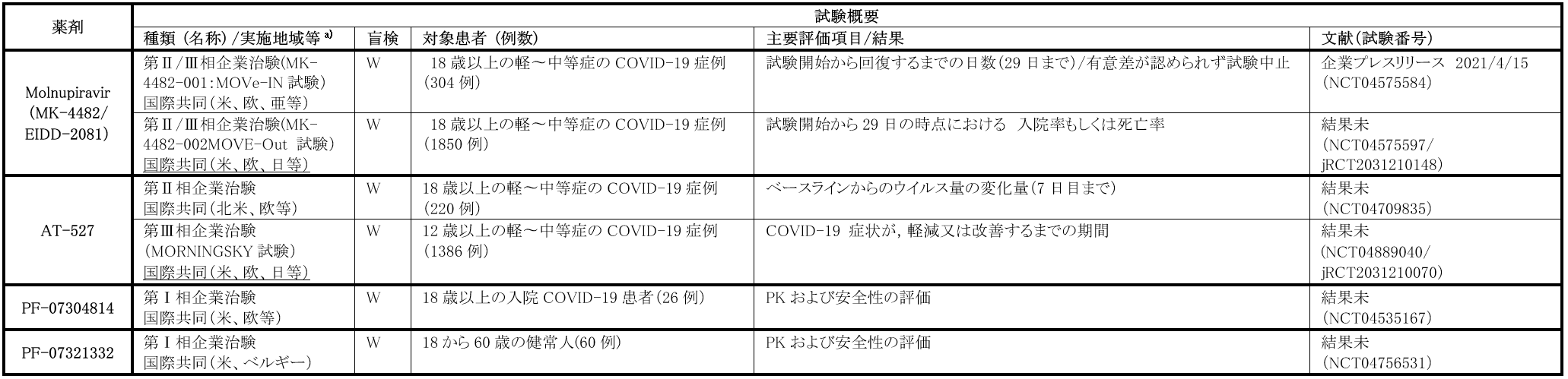
COVID-19に対しては、入院患者対象のMOVe-IN試験(MK-4482-001)と、外来患者対象のMOVe-Out試験(MK-4482-002)が、プラセボ対照二重盲検RCTとして実施されており、いずれの試験も用量探索パートのⅡ相試験後、選択された用量での臨床効果の検証を行う第Ⅲ相試験に移行するデザインとなっている。用量探索パートの結果に関するプレスリリースにて、MOVe-IN試験では本剤の臨床的有用性が確認されなかったが、MOVe-OUT試験にて、統計学的な有意差は認めないもののプラセボ群と比較して本剤投与群にて入院又は死亡率が低下する傾向があり、外部のデータモニタリング委員会の勧告を受け、重症化因子を有する発症早期外来患者に対象を限定した国際共同第Ⅲ相MOVe-OUT試験が実施予定である。国内では、本剤を用いた国内第Ⅰ相試験(jRCT2031210010)を実施中であり、今後上記第Ⅲ相MOVe-OUT試験へ参加予定である。
2) AT-527(中外製薬/ロシュ株式会社)
RdRPによる転写を阻害するグアノシンの核酸アナログ製剤であり、C型肝炎の治療薬として開発が進められてきた経口摂取が可能な化合物である[8]。In vitroでSARS-CoV-2の増殖を阻害することが報告されている[9]。本剤は厚生労働省の「新型コロナウイルス感染症治療薬の実用化のための支援事業(以下、支援事業)」の対象品目であり、現在軽症~中等症外来患者対象の国際共同第Ⅲ相試験(MORNINGSKY Trial)に、本邦も参加している。
3) PF-07304814/PF-07321332(ファイザー株式会社)
Rd RpとともにSARS-CoV-2の複製に必須の酵素であるmain proteaseは治療薬開発の標的の一つである[10]。これらの化合物はSASR-CoV-2のmain proteaseを狙った阻害剤で、前者はPF-00835231のpro-drugになる静脈内投与製剤、後者は経口薬であり、両剤とも現在海外で第Ⅰ相試験が実施されている(NCT04535167、NCT04756531)。両剤も支援事業の対象品目であり、今後国内開発が進められることが期待されている。
B. 血漿療法/抗体製剤【表2-2】
病原体に対する抗体を含有することが想定される回復者血漿(convalescent plasma: CP)を採取し患者に投与する血漿療法は、古くはスペイン風邪、近年ではエボラ出血熱やSARS、MERS等の重症感染症で試行された治療法であり、COVID-19においても多くの臨床試験が実施されている。中国で実施された重症COVID-19患者対象非盲検RCTでは、挿管には至っていない患者群では有効性が示された一方、患者全体及び人工呼吸管理を必要とした患者群では有効性は示されなかった[11]。インドで実施された中等症対象の非盲検RCT[12]、アルゼンチンで実施された重症肺炎対象のプラセボ対照二重盲検RCTでも血漿交換の有効性は示されなかった[13]。ただし、高齢者等重症化リスクの高い軽症患者を対象に発症3日以内に高力価の血漿輸注を行いプラセボとの効果を比較する二重盲検RCTでは、血漿投与により重症化率が低くなることが示された。国立国際医療研究センターでは、同意取得の得られた回復患者のうち、中和活性を有する抗体が確認できた患者より血漿を採取し保存しており、入院患者59例に血漿輸注を行いヒストリカルコントロールと比較する非盲検単群試験(jRCTs031200124)の他、重症化リスクを有する発症早期の軽症患者200例を対象とした非盲検RCT(jRCTs031200374)を、特定臨床研究として実施中である。
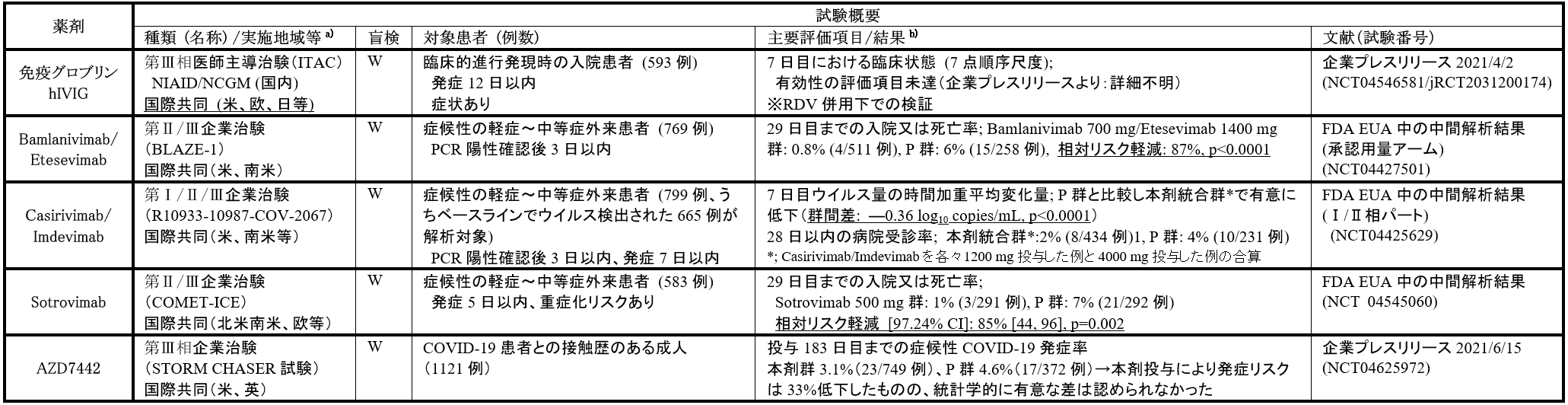
また、回復者血漿から一定量かつ高濃度の抗体を含有する抗SARS-CoV-2高度免疫グロブリン製剤(H-Ig)を精製し、医薬品として臨床効果を検証する試みもある。NIAID主導で、CoVIg-19アライアンス(CSL Behring、武田薬品他4社)よりH-Igの提供を受け、重篤化リスクを有する成人COVID-19入院患者593例を対象に、レムデシビル併用下に疾患リスク軽減効果を評価する国際共同プラセボ対照二重盲検RCT(ITAC試験)が実施され、国内の医療期間も参加したが、CoVIg-19アライアンスグループからの報告では、主要評価項目について統計学的に有意な差は認められなかったとされた。
その他、感染回復者から、SARS-Cov-2のスパイク蛋白上の受容体結合ドメイン(RBD)を標的とした中和抗体を同定・分離し、新規抗ウイルス薬として開発する試みも進行中である。現在臨床試験での有効性を示唆する結果に基づきFDAから緊急使用許可を取得し、重症化リスクを有する軽症~中等症外来患者に投与可能な抗体製剤は、下記の1) ~3) の製剤のみである。
| 表2-2 |
| 開発が進む新規薬剤(抗体製剤) |
 |
| 略語:W(二重盲検)、S×(非盲検)、P群:プラセボ群、a) 下線は本邦参加あり、b) [ ]は95%信頼区間 (CI)、下線は統計学的に有意な結果 |
1) Bamlanivimab(LY3819253 or LY-CoV555)/ Etesevimab(LY3832479 or LY-CoV016)[イーライリリー株式会社]
両抗体は、各々北米と中国のCOVID-19回復者血漿より分離された抗体を基に開発された中和抗体であり、認識するエピトープは一部異なるものの重複している。発症早期の軽症~中等症外来患者を対象としたBLAZE-1試験のⅡ相パートでは、Bamlanivimab 700 mg(101例)、2800 mg(107例)、 7000 mg(101例)又はBamlanivimab 2800 mg+Etesevimab 2800 mg(112例)の単回静脈内投与から11日目のウイルス減少量を、プラセボ(156例)と比較した。ベースラインからのウイルス変化量は、プラセボ群-3.80 Logに対し、各投与群で各々-3.72 、-4.08、-3.49及び―4.37 Logであり、併用群においてプラセボとの有意差が確認された(群間差:-0.57[-1.00, ―0.14]、p=0.01)。同試験のⅢ相パートでは、Bamlanivimab 700 mg+Etesevimab 1400 mg群とBamlanivimab 2800 mg+Etesevimab 2800 mg群が設定され、投与後29日目の入院又は死亡率を、各々のプラセボ対照群と比較した。
FDAに提出された中間解析結果における入院又は死亡率は、Bamlanivimab 700 mg+Etesevimab 1400 mg群0.8%(4/511例)、その対照群6%(15/258例)、Bamlanivimab 2800 mg+Etesevimab 2800 mg群2%(11/518例)、その対照群7%(36/517例)であり、Bamlanivimab 700 mg+Etesevimab 1400 mg群で87%、Bamlanivimab 2800 mg+Etesevimab 2800 mg群で70%の入院又は死亡リスク軽減が得られた。本試験結果を踏まえ、FDAはBamlanivimab 700 mg+Etesevimab 700 mgのカクテル製剤について2021年2月9日緊急使用許可を発出した。なお、Bamlanivimab 700 mg単独投与については[14]、変異株の拡散状況に伴い、2020年11月9日に発出された緊急使用許可が2021年4月16日に取り消された。国内での開発予定は現時点では不明である。
2) Casirivimab(REGN10933)/ Imdevimab(REGN10987)[REGN-COV2:リジェネロン/ロシュ/中外製薬株式会社]
REGN-COV2 は、リジェネロンにより創薬された2つの中和抗体(imdevimab、Casirivimab)のカクテル製剤であり、RBD上の異なるエピトープを認識し非競合的に結合する。発症早期の軽症~中等症外来患者を対象としたREGN-COV 2067試験のⅠ/Ⅱ相パートでは、本剤2400 mg(Casirivimab 1200 mg+Imdevimab 1200 mg:266例)、8000 mg (Casirivimab 4000 mg+Imdevimab 4000 mg:267例)又はプラセボ(266例)を単回静脈内投与し、7日目までのウイルス量の時間加重平均変化量を比較した。ベースラインでウイルス検出を認めた患者集団において、プラセボと比較し本剤いずれかの用量を投与された集団でウイルス量は有意に低下し(群間差: ―0.36 log10 copies/mL, p<0.0001)、副次的評価項目である投与後28日以内の病院受診率は、プラセボ群4%に対し、本剤群2%であった。
本試験結果を踏まえ、FDAはREGN-COV2 2400 mgカクテル製剤について2020年11月21日緊急使用許可を発出した。なお、重症化リスクを有する外来患者に対象者を限定し実施された同試験の第Ⅲ相パートでの投与後29日目の入院又は死亡率は、本剤2400 mg群1.3%(18/1355例)、本剤1200 mg群1.0%(7/736例)であり、各々のプラセボ対照群と比較した入院死亡リスク軽減は各々71%(p<0.0001)及び70%(p=0.0024)であった(プレスリリースより)。本試験の他、COVID-19患者の家庭内濃厚接触者に対し本剤1200 mgを単回皮下投与し、投与後29日以内の症候性感染予防効果を検証する臨床試験も実施され(REGN-COV 2069試験: NCT04452318)、プラセボ群7.8%(59/752例)に対し本剤群1.5%(11/753例)と、発症リスクを81%減少させた(企業プレスリリースより)。
本剤は、支援事業の対象品目であり、健康成人対象の国内第Ⅰ相試験(jRCT2071200117)成績と海外治験成績を基に、2021年6月29日に製造販売承認申請が提出されている。
3) Sotrovimab(VIR-7831 / GSK4182136)[グラクソ・スミスクライン株式会社]
Sotrovimab は2003年のSARS回復者から分離された抗体を基に開発された単クローン抗体製剤であり、SARS-CovとSARS-Cov-2間に共通して保存されるスパイク糖タンパクのRBD領域上のエピトープを認識するため、変異株等に対しても幅広いスペクトラムを有することが推測されている。重症化リスクを有する発症早期の軽症~中等症外来患者を対象としたCOMET-ICE試験では、本剤500 mg又はプラセボの単回静脈内投与から29日目までの入院又は死亡率を評価した。FDAに提出された中間解析の結果では、プラセボ群7% (21/292例)に対し本剤群1% (3/291例)であり、入院又は死亡リスクを85%減少させた(p=0.002)。本結果を踏まえ、FDAはSotrovimab 500 mgの緊急使用許可を2021年5月26日に発出した。
本剤も上述の支援事業の対象品目であり、今後国内開発が進められることが期待される。
4) AZD7442(Tixagevimab:AZD8895 / Cilgavimab:AZD1061)[アストラゼネカ株式会社][15]
AZD7442は、SARS-CoV-2ウイルスに感染した回復期の患者が持つ2種類の抗体(AZD8895及びAZD1061)を組み合わせた長時間作用型抗体(LAAB)である。本剤を用いた複数の臨床試験が進行中であるが、COVID-19患者と接触した人を対象に、本剤300mg単回投与後183日目までの発症予防効果を検証するプラセボ対照第Ⅲ相RCT(STORM CHASER試験:NCT04625972)では、プラセボ群4.6%(17/372例)に対しで本剤群3.1%(23/749例)と、本剤投与により発症リスクは33%低下したものの、統計学的に有意な差は認められなかった(企業プレスリリースより)。本邦では、国内第Ⅰ相試験(jRCT2071200111)の他、発症早期軽症非入院患者を対象に、AZD7442 600 mg (AZD8895及びAZD1061各300 mg)単回筋肉内投与後29日目までの重症化又は全死亡の複合評価項目をプラセボと比較する国際共同企業治験(TACKLE試験:NCT04723394/jRCT2031200368)に参加している。
Ⅲ. 開発中の薬剤(既存薬等)
COVID-19のような新興感染症では、発生時点では治療薬は存在しないことが多い。このような状況で取りうる手段として、既存薬や他効能で開発中の医薬品の中からの有効薬剤の探索(repurposing)がある[14]。この手法では新薬開発の大きな壁である「安全性」がある程度担保できていることから、有効なものが見出せれば大きな社会的効果が期待される。以下のような既存薬が候補として取り上げられ、本邦においても臨床試験が実施されている。
A. 抗ウイルス効果が期待される既存薬【表3-1】
1) ファビピラビル[アビガン:富士フィルム富山化学株式会社]
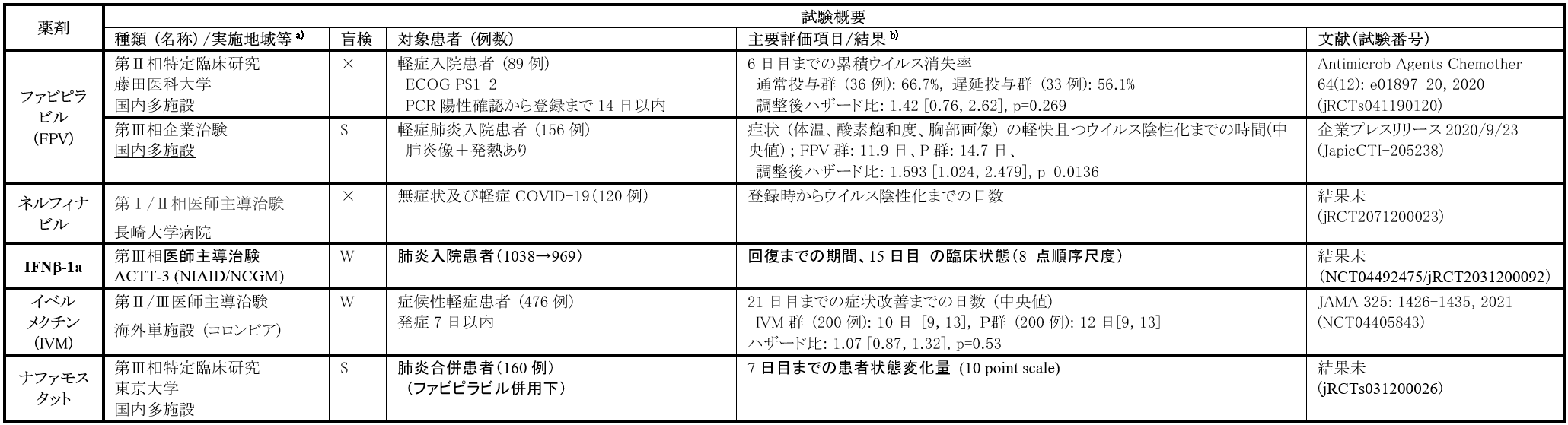
ファビピラビルは本邦で開発されたRNAポリメラーゼ阻害薬で、元々インフルエンザ感染症の治療薬として開発されたが[16]、催奇形性を有すること等から上記効能についてはリスクベネフィットバランスが得られないとの判断で承認されず、製造販売は行われていない。しかし、作用機序から従来の抗インフルエンザウイルス薬が無効又は効果不十分な新型又は再興型インフルエンザウイルス感染症に対し治療効果が得られる可能性を鑑み、当該インフルエンザウイルスへの対策に使用すると国が判断した場合にのみ、患者への投与が検討される医薬品として承認を受け、国内に備蓄されている。COVID-19に対しても作用機序から治療効果が得られる可能性があることから、本邦においては、COVID-19入院患者に対して医療機関の判断で本剤をCompassionate useとして投与する場合、藤田医科大学が実施する抗ウイルス薬観察研究への参加を前提に薬剤が提供されており、2021年2月28日現在、抗ウイルス薬観察研究への登録患者数は10956例である。
国内で実施された臨床試験としては、藤田医科大学が代表施設として実施された特定臨床研究と企業治験がある。前者は、無症状・軽症患者89例を対象に、本剤を1日目より投与開始する通常投与群と、6日目より投与開始する遅延投与群の2群を比較する多施設共同非盲検RCTであり、主要評価項目である6日目までの累積ウイルス消失率は、通常投与群で66.7%、遅延投与群で56.1%、調整後ハザード比は1.42[0.76, 2.62](p=0.269)と、陰性化率は通常投与群で高い傾向を認めるものの統計学的に有意な差は認められず、他の有効性評価項目についても同様に両群に有意差は示されなかった。後者は、肺炎患者を対象としたプラセボ対照単盲検RCTであり、中間評価の結果に応じて症例数を増やすアダプティブデザインで実施され、中間評価を行った独立委員会からの勧告により、当初の予定症例数96例から症例数が増加され、最終的に156例の患者が登録された。主要評価項目は症状(体温、酸素飽和度、胸部画像)の軽快且つウイルス陰性化までの時間と設定され、各群の中央値は本剤群11.9日、プラセボ群14.7日、調整後ハザード比1.593[1.024, 2.479](p=0.0136)であり、統計学的に有意な差を認めた。
本結果を踏まえ、2020年10月に製造販売承認事項一部変更承認申請が提出され、12月の薬事・食品衛生審議会医薬品第二部会において審議されたが、単盲検試験で実施されたことによる影響や主要評価項目以外も含めた各評価項目における結果の臨床的意義等について議論の上、現時点で得られたデータからは本剤の有効性を明確に判断することが困難と判断され、現在米国等で実施中の臨床試験結果等の提出を待って、再審議(継続審議)されることとなった。なお、2021年4月より、重症化リスク因子をもつ発症早期COVID-19患者316例を対象としたプラセボ対照二重盲検RCTが国内企業治験として実施中である(jRCT2041210004)。
2) ネルフィナビル[ビラセプト:日本たばこ産業株式会社]
HIV感染症の薬として国内で承認取得を得ている古典的なHIVプロテアーゼ阻害薬であるが[17]、現在製造販売は終了しており、HIV感染症治療にはほとんど使用されていない。in vitroでSARS-CoV-2に対する増殖抑制効果があることが東京理科大学・国立感染症研究所のグループから報告され[18]、現在長崎大学を中心に、無症状及び軽症COVID-19 患者120 例を対象に、PCR陰性化までの期間を評価する非盲検RCTが医師主導治験として実施中である[19](jRCT2071200023)。
3) インターフェロンb-1a[Rebif:サノフィ株式会社](国内未承認薬)
抗ウイルス活性を有するサイトカインであるインターフェロンを用いた臨床試験も各国で実施されたが、本邦参加の臨床試験としては、レムデシビル併用下でのRebifの有効性及び安全性を評価するNIAID主導のACTT-3試験(NCT04492475/jRCT2031200092)がある。本剤は国内では未承認薬であるが、海外では多発性骨髄腫での適応を有する承認薬である。
4) イベルメクチン[ストロメクトール:MSD株式会社]
本剤は、世界的に糸状虫症等の治療で広く使われているマクロライド系抗寄生虫薬であり[20]、国内では腸管糞線虫症や疥癬の治療薬として承認されている。本薬剤を発見した北里大学特別栄誉教授大村智氏はその業績により2015年ノーベル医学・生理学を受賞された。オーストラリアの研究グループより、in vitroの系でSARS-CoV-2の増殖を抑制したとの報告があり、COVID-19治療薬候補として注目されている一方、上記薬効をヒトで得るためには現在の承認用量の約100倍以上の投与量が必要であるともされており、十分な臨床効果が得られるか疑問視する意見もある。COVID-19入院患者280例を対象に、本剤による院内死亡抑制効果を後ろ向きに評価したICON試験にて、標準治療群での死亡率25.2%と比べ本剤群15.0%と、有意に死亡率が低かった(オッズ比0.52[0.29, 0.96]、P=0.03)[21]。この他、小規模なRCTや、本剤を用いた臨床試験のメタ解析の結果から本剤の有効性を示唆する報告がある一方、軽症成人COVID-19患者400例を対象としたプラセボ対照二重盲検RCT(NCT04405843)では、症状改善までの日数の中央値は本剤群10日、プラセボ群12日、ハザード比1.07[0.87, 1.32](p=0.53)と、両群で有意差を認めなかった。
本邦では、北里大学主導で実施中の医師主導治験(jRCT2031200120)の他、興和株式会社が今後企業治験を実施予定とのことであり(プレスリリース2021年7月1日)、その結果が待たれる。
5) ナファモスタット[フサン:日医工株式会社]
本剤も国内で承認されているセリンプロテアーゼ阻害薬であり、カモスタットと同様の機序で抗ウイルス効果があると期待されるが、カモスタットと比較して本剤は約1/10 以下の低濃度でウイルスの侵入過程を阻止したとのin vitroの報告がある[29]。現在、肺炎合併COVID-19患者160例を対象に、ファビピラビル併用下で本剤の臨床効果を検証する多施設共同単盲検RCTが、東京大学主導の特定臨床研究として実施中である(jRCTs031200026)。
| 表3-1 |
| 抗ウイルス効果が期待される既存薬 |
 |
| 略語:W(二重盲検)、S(単盲検)、×(非盲検)、P群:プラセボ群、a) 下線は本邦参加あり、b) [ ]は95%信頼区間、下線は統計学的に有意な結果 |
B. 抗炎症効果が期待される既存薬【表3-2】
1) IL-6阻害薬:トリシズマブ(Tocilizumab: TCZ)[アクテムラ:中外製薬/ロシュ株式会社]、サリルマブ(Sarilumab: SLM)[ケブザラ:サノフィ株式会社]
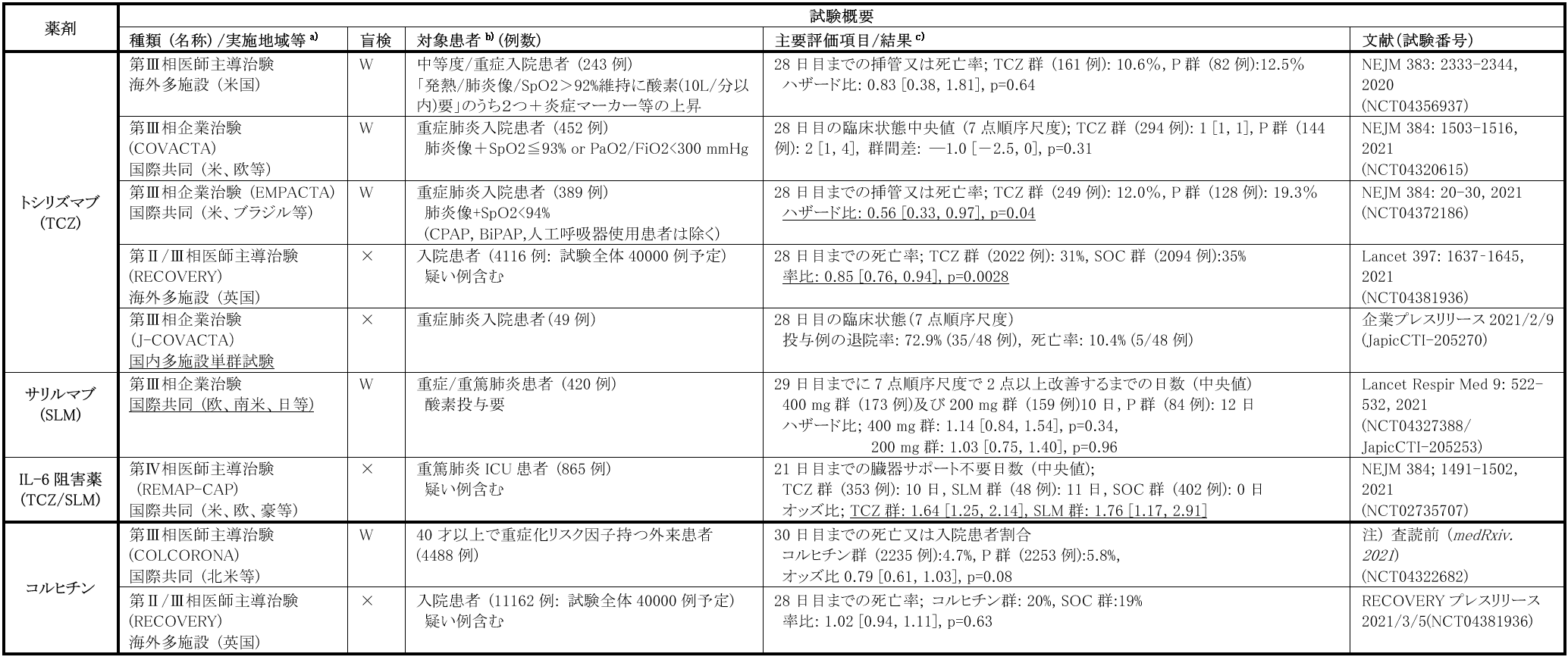
炎症性サイトカインIL-6の選択的阻害薬として、本邦では抗IL-6受容体抗体であるTCZとSLMがRA等の適応で承認されている[22]。TCZは皮下注射製剤と静脈内投与製剤があり、後者はRA等の慢性炎症性疾患の他、腫瘍特異的T細胞輸注療法に伴うサイトカイン放出症候群(CRS)にも適応を有する。重症COVID-19ではT細胞や単球等から産生されるIL-6がCRS様病態に寄与している可能性があり、治療標的となりうる。
複数のRCTでTCZによる死亡率の低下は認められなかったが、侵襲的酸素投与又は死亡に至った患者割合を評価したEMPACTA試験ではTCZの有用性が示された。また、REMAP-CAPグループ主導で実施された大規模な非盲検ランダム化アダプティブプラットフォーム試験やRECOVERY試験でもIL-6阻害薬の有用性が示されており、これらのプラットフォーム試験とRCTsの結果の差異は、治療体系の変化に伴いデキサメタゾンの併用率が大きく異なることが一因と考えられる。これらの知見を踏まえ、NIHガイドラインでは、人工呼吸器/高流量酸素を要する患者や、急速に酸素化の悪化を認めCRP値等の炎症マーカーの上昇を認める患者等に対して、デキサメタゾン併用下でのTCZ (8 mg/kg[最大800 mg/body]単回静脈内投与) 投与推奨が追記され、FDAは、人工呼吸器、ECMO管理含めた酸素投与を要し、ステロイド投与を受けている入院中の成人および2歳以上の小児COVID-19患者に対する本剤の緊急使用許可を2021年6月24日に発出した。国内では、非盲検単群国内第Ⅲ相試験(J-COVACTA 試験:JapicCTI-205270)が企業治験として実施されており、今後承認申請について規制当局と協議予定とのことである。
なお、SLMについては、プラセボ、SLM400 mg又は200 mgを重症/重篤肺炎患者に単回静脈内投与を行う企業治験が実施されたが、いずれの用量においてもプラセボ群との有意な差は認められず、NIHガイドラインにおいても、REMAP-CAP試験においてSLMの症例数は限られていること、TCZと異なり既承認疾患では静脈内投与製剤は承認されておらずCRSでの適応を有していないこと等から、現時点ではSLMの有用性を評価するデータは不足しているとの記載にとどまっている。
2) コルヒチン(高田製薬株式会社)
好中球活性化及び遊走阻止作用を持つ抗炎症薬で、痛風予防や家族性地中海熱に対して承認されている。軽症外来患者対象RCT(COLCORONA試験)では主要評価項目は達成しなかったものの、PCR陽性確定例での入院/死亡リスクは本剤群にて低くなる傾向を認めた。一方、RECOVERY試験では本剤投与による死亡率改善効果は認められず、本剤アームの組入を中止した。本邦では、重症化リスク因子を有する軽症又は中等症患者対象のプラセボ対照二重盲検RCTが、琉球大学主導の医師主導治験として行われている(jRCT2071200078)。
| 表3-2 |
| 抗炎症効果が期待される既存薬 |
 |
| 略語:W(二重盲検)、S(単盲検)、×(非盲検)、P群:プラセボ群、SOC群:標準治療群、a) 下線は本邦参加あり、b) SpO2は室内気の値、c) [ ]は95%信頼区間、下線は統計学的に有意な結果 |
C. その他
以下の薬剤は、他疾患等で開発中の未承認薬であり、COVID-19についても現在臨床試験が実施されている。
1) アドレノメデュリン
ヒト褐色細胞腫組織から発見された血管拡張作用を有する生理活性ペプチドであり、重症患者における血管障害や多臓器障害を抑制する可能性が検討されている。現在、国内において、宮崎大学主導で、人工呼吸器管理を要する患者40例を対象に、プラセボ対照二重盲検RCTを医師主導治験として実施中の他(jRCT2071200041)、中等症肺炎の重症化予防を検証する医師主導治験も開始されている(jRCT2071210038)。
2) オチリマブ(Otilimab)[グラクソ・スミスクライン株式会社]
RAの治療薬として開発中の抗GM-CSF抗体である[23]。抗炎症作用を期待してCOVID-19患者へ投与し、炎症を抑制する試みもある。
重症患者806例を対象に企業治験として実施された国際共同多施設プラセボ対照二重盲検RCT(OSCAR試験:NCT04376684/JapicCTI-205344)では、主要評価項目にて統計学的有意差は示されなかったが、重症化リスクの高い70歳以上の患者群で本剤での治療効果が得られる可能性が示唆されるため、本コホートを拡大する修正を行い引き続き検討中とのことである。
3) サルグラモスチム[ノーベルファーマ株式会社]
本剤は自己免疫性肺胞蛋白症治療薬として開発中のGM-CSF製剤であり、ベルギーで実施中の本剤吸入の臨床試験の中間解析の結果、本剤群で肺換気-動脈血酸素分圧較差の改善が示唆されている。現在本邦にて、プラセボ対照二重盲検RCTが企業治験として実施中である(jRCT2031200180)。
4) エリトラン(E5564)
エリトランはTLR(トール様受容体)4の活性化阻害薬であり、重症敗血症の治療薬として開発されていたが臨床での有効性が認められず開発が中止となった薬剤である[24]。COVID-19におけるサイトカインストームに対する治療効果を検討するため、REMAP-CAP主導の大規模非盲検ランダム化アダプティブプラットフォーム試験の中で評価が行われている。国内でもその一環としての国内医師主導治験が実施中である(jRCT2031200443)。
5) TM5614(プラスミノゲンアクチベーターインヒビター-1阻害薬)
TM5614は、血栓溶解、肺の炎症や線維化を改善する作用を有する本邦で開発されたPAI-1阻害薬であり、東北大学を中心に実施された非盲検単群試験(jRCT2021200018)の結果を踏まえ、プラセボ対照二重盲検第II相医師主導治験(jRCT2021210006)が実施予定である。
6) エフェドリンアルカロイド除去麻黄エキス(EFE)
本剤は、麻黄から副作用に関連するエフェドリンアルカロイドを除去した製剤であり、北里大学主導で、感染初期患者を対象とした探索的試験が実施中である(jRCT2031210063)。
D. 有効性が確認されなかった、もしくは開発が中止された薬剤【表4】
1) ロピナビル・リトナビル(LPV/r)[カレトラ:アッヴ合同会社]
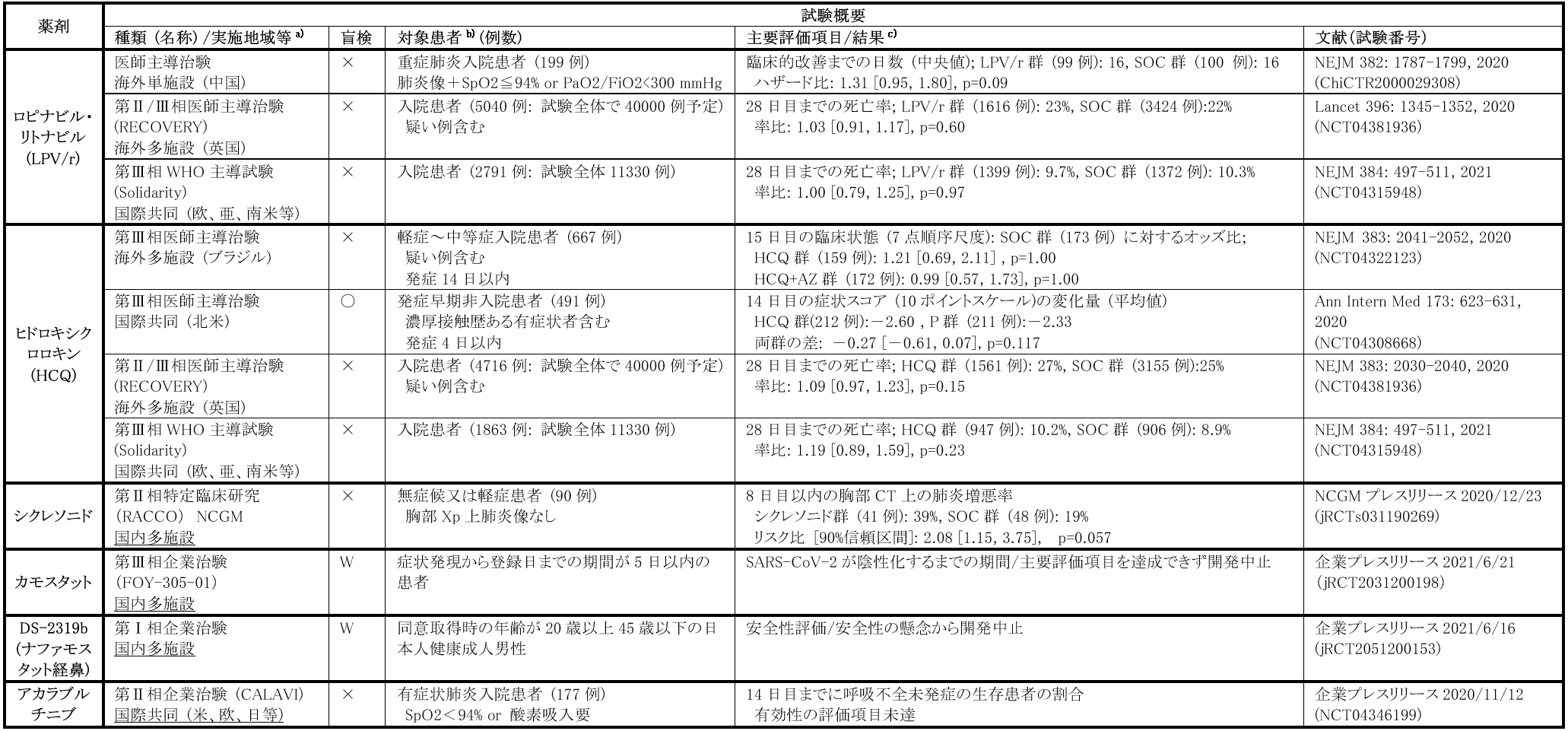
本剤はHIVプロテアーゼ阻害薬であり、HIV感染症の治療薬として国内で承認されている[25]。in vitroでの抗ウイルス活性の他、コンピューター上の構造解析によりパンデミック初期に候補薬の一つとして着目された。しかし、中国で実施された重症COVID-19患者対象非盲検RCT、前述のRECOVERY試験やSolidarity試験の本剤アームの成績等の結果は、いずれも本剤投与による臨床効果は明らかではなく、COVID-19患者への本剤投与は推奨されない。
2) クロロキン(CQ)/ヒドロキシクロロキン(HCQ)[プラケニル:サノフィ株式会社]
CQ及びそのアナログ製剤であるHCQは、海外では抗マラリア薬として使用されるとともに、免疫調整薬として自己免疫疾患の治療等にも用いられている[26]。本邦ではHCQが全身性エリテマトーデスの治療薬として承認されている。in vitroの系で両剤によるSARS-CoV-2増殖抑制効果が認められたことから、パンデミック初期より有望な治療薬候補として着目され、FDAは2020年3月28日に両剤の緊急使用許可を発出した。また、マクロライド系抗菌薬であるアジスロマイシン(AZ)との併用でウイルス陰性化率が高いとの報告もあり、CQ又はHCQ単独投与の他、AZ併用による臨床効果を検証する試験が各国で実施された。しかしながら、症例の集積に伴い、明確な有効性が確認されない一方、CQ/HCQ用量依存性にQT延長の報告が散見され潜在的な心毒性が懸念されることより、同年6月15日にFDAは両剤の緊急使用許可を取り消した。主なRCTとして、入院COVID-19患者を対象にHCQ群、HCQ+AZ群及び標準治療群の3群での臨床転帰を比較した非盲検RCT、早期非入院COVID-19患者を対象にHCQ群とプラセボ群に割り付けた二重盲検RCTの他、上述したRECOVERY試験やSolidarity試験にてHCQアームと標準治療群の比較が行われているが、いずれの試験においても明確な有効性は確認されなかった。
なお、英国では、合併症リスクの高い市中COVID-19疑い例についても、複数の薬剤の有用性を同時に評価する非盲検無作為化アダプティブプラットフォーム試験(PRINCIPLE試験:ISRCTN86534580)が実施されており[27]、AZ投与アーム(540例)を標準治療アーム(875例)と比較した試験結果では、回復までの期間の短縮や入院リスクの軽減等の臨床的有用性はAZ投与で得られなかった。
3) カモスタット[フォイパン:小野薬品工業株式会社]
本剤は慢性膵炎の治療薬として国内で承認を取得している経口セリンプロテアーゼ阻害薬である。本剤が気道上皮細胞上に発現するTMPRSS2を阻害し、SARS-CoV-2ウイルスのS1-S2の切断を阻害し、標的細胞への侵入時の膜融合を阻害することで抗ウイルス作用を有するとの報告があり[28]、COVID-19治療薬として期待された。本剤については、基礎論文での報告やヒト血中濃度の関係性を踏まえ、健康成人を対象に既承認用量を超えた用量での安全性確認のための臨床第Ⅰ相試験を実施後、無症状から中等症の新型コロナ患者153例を対象に、カモスタット600 mg一日4回、最大14日間経口投与し、プラセボとの有効性及び安全性を比較した国内企業治験が実施された(FOY-305-01:jRCT2031200198)。しかし、主要評価項目であるSARS-CoV-2が陰性化するまでの期間につき、両群で統計学的に有意な差は認められず、開発は中止された(企業プレスリリースより)。
4) シクレソニド[オルベスコ:帝人ファーマ株式会社]
本剤は、気管支喘息の薬として国内で承認を取得している吸入ステロイド製剤であり、ステロイド剤としての抗炎症効果の他、非臨床試験においてSARS-CoV-2に対する抗ウイルス活性が確認されたことから[30]、COVID-19治療薬候補として着目され、本剤投与にて症状の改善の得られた症例報告もパンデミック初期に発表された。しかし、国立国際医療研究センターを中心に特定臨床研究として実施された無症状・軽症患者90例対象の多施設共同非盲検ランダム化第Ⅱ相試験(jRCTs031190269)では、主要評価項目である肺炎増悪率は本剤群39%(16/41例)、対症療法群19%(9/48例)、リスク比 2.08(90%信頼区間 1.15-3.75)で、有意に本剤群で高く(p=0.057)、研究グループは「米国含む海外にて実施されている検証的な臨床試験の結果も踏まえて判断する必要はあるが、今回の研究結果からは、無症状・軽症のCOVID-19患者に対する本剤の投与は推奨できない」と結論づけている。
5) ナファモスタット経鼻[DS-2319b:第一三共株式会社]
日本人健康成人を対象とした単回及び反復吸入投与時の安全性及び薬物動態の検討する第Ⅰ相試験(jRCT2051200153)が企業治験として実施されたが、安全性上の懸念にて開発が中止されたとのことである。
6) アカラブルチニブ[カルケンス:アストラゼネカ株式会社](Btk阻害薬)
B細胞受容体のシグナル伝達に重要なブルトン型チロシンキナーゼ(Btk)を阻害するアカラブルチニブは慢性リンパ性白血病の治療に適応を有する[31]。本剤を投与された重症患者において、炎症マーカーの低下とともに、臨床転帰の改善を認めたとの報告があり[32]、本剤の臨床効果を検証する国際共同非盲検RCT(CALAVI試験:NCT04346199)が実施され、本邦も参加したが、標準治療への追加療法としてのアカラブルチニブは、呼吸不全未発症の生存患者の割合を増加させなかったと報告された(企業プレスリリースより)。
| 表4 |
| 有効性が確認されなかった・開発が中止となった薬剤 |
 |
| 略語:W(二重盲検)、S(単盲検)、×(非盲検)、P群:プラセボ群、SOC群:標準治療群、a) 下線は本邦参加あり、b) SpO2は室内気の値、c) [ ]は95%信頼区間、下線は統計学的に有意な結果 |
おわりに
以上、COVID-19治療薬の開発状況を紹介してきたが、表に示したようにほかに有効性が確認されず脱落した薬剤も多数存在し、これらも加えるとこの一年の間に非常に多くの試験が行われてきたことがわかる。それにもかかわらず本項執筆時点では承認薬剤は3種類に留まっており、治療薬開発のハードルの高さが認識される。
低分子化合物の抗ウイルス剤等がphase III試験にさしかかっていることもあり、優れた治療薬の登場が間近いことを期待する。
[引用文献]
- NIH. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines (2020).
- Wang, M. et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res 30, 269-271, doi:10.1038/s41422-020-0282-0 (2020).
- Arabi, Y. M. et al. Corticosteroid Therapy for Critically Ill Patients with Middle East Respiratory Syndrome. Am J Respir Crit Care Med 197, 757-767, doi:10.1164/rccm.201706-1172OC (2018).
- Stockman, L. J., Bellamy, R. & Garner, P. SARS: systematic review of treatment effects. PLoS Med 3, e343, doi:10.1371/journal.pmed.0030343 (2006).
- Stebbing, J. et al. COVID-19: combining antiviral and anti-inflammatory treatments. Lancet Infect Dis 20, 400-402, doi:10.1016/s1473-3099(20)30132-8 (2020).
- Cox, R. M., Wolf, J. D. & Plemper, R. K. Therapeutically administered ribonucleoside analogue MK-4482/EIDD-2801 blocks SARS-CoV-2 transmission in ferrets. Nat Microbiol 6, 11-18, doi:10.1038/s41564-020-00835-2 (2021).
- Urakova, N. et al. β-d-N (4)-Hydroxycytidine Is a Potent Anti-alphavirus Compound That Induces a High Level of Mutations in the Viral Genome. J Virol 92, doi:10.1128/jvi.01965-17 (2018).
- Berliba, E. et al. Safety, pharmacokinetics and antiviral activity of AT-527, a novel purine nucleotide prodrug, in HCV-infected subjects with and without cirrhosis. Antimicrob Agents Chemother 63, doi:10.1128/aac.01201-19 (2019).
- Good, S. S. et al. AT-527, a Double Prodrug of a Guanosine Nucleotide Analog, Is a Potent Inhibitor of SARS-CoV-2 In Vitro and a Promising Oral Antiviral for Treatment of COVID-19. Antimicrob Agents Chemother 65, doi:10.1128/aac.02479-20 (2021).
- Vandyck, K. & Deval, J. Considerations for the discovery and development of 3-chymotrypsin-like cysteine protease inhibitors targeting SARS-CoV-2 infection. Curr Opin Virol 49, 36-40, doi:10.1016/j.coviro.2021.04.006 (2021).
- Li, L. et al. Effect of Convalescent Plasma Therapy on Time to Clinical Improvement in Patients With Severe and Life-threatening COVID-19: A Randomized Clinical Trial. Jama 324, 460-470, doi:10.1001/jama.2020.10044 (2020).
- Agarwal, A. et al. Convalescent plasma in the management of moderate covid-19 in adults in India: open label phase II multicentre randomised controlled trial (PLACID Trial). Bmj 371, m3939, doi:10.1136/bmj.m3939 (2020).
- Simonovich, V. A. et al. A Randomized Trial of Convalescent Plasma in Covid-19 Severe Pneumonia. N Engl J Med 384, 619-629, doi:10.1056/NEJMoa2031304 (2021).
- Chen, P. et al. SARS-CoV-2 Neutralizing Antibody LY-CoV555 in Outpatients with Covid-19. N Engl J Med 384, 229-237, doi:10.1056/NEJMoa2029849 (2021).
- Dong, J. et al. Genetic and structural basis for recognition of SARS-CoV-2 spike protein by a two-antibody cocktail. bioRxiv, doi:10.1101/2021.01.27.428529 (2021).
- Furuta, Y. et al. In vitro and in vivo activities of anti-influenza virus compound T-705. Antimicrob Agents Chemother 46, 977-981, doi:10.1128/aac.46.4.977-981.2002 (2002).
- Kaldor, S. W. et al. Viracept (nelfinavir mesylate, AG1343): a potent, orally bioavailable inhibitor of HIV-1 protease. J Med Chem 40, 3979-3985, doi:10.1021/jm9704098 (1997).
- Ohashi, H. et al. Potential anti-COVID-19 agents, cepharanthine and nelfinavir, and their usage for combination treatment. iScience 24, 102367, doi:10.1016/j.isci.2021.102367 (2021).
- Hosogaya, N. et al. Efficacy and safety of nelfinavir in asymptomatic and mild COVID-19 patients: a structured summary of a study protocol for a multicenter, randomized controlled trial. Trials 22, 309, doi:10.1186/s13063-021-05282-w (2021).
- Campbell, W. C., Fisher, M. H., Stapley, E. O., Albers-Schönberg, G. & Jacob, T. A. Ivermectin: a potent new antiparasitic agent. Science 221, 823-828, doi:10.1126/science.6308762 (1983).
- Rajter, J. C. et al. Use of Ivermectin Is Associated With Lower Mortality in Hospitalized Patients With Coronavirus Disease 2019: The Ivermectin in COVID Nineteen Study. Chest 159, 85-92, doi:10.1016/j.chest.2020.10.009 (2021).
- Sebba, A. Tocilizumab: the first interleukin-6-receptor inhibitor. Am J Health Syst Pharm 65, 1413-1418, doi:10.2146/ajhp070449 (2008).
- Kerschbaumer, A. et al. Efficacy of pharmacological treatment in rheumatoid arthritis: a systematic literature research informing the 2019 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 79, 744-759, doi:10.1136/annrheumdis-2019-216656 (2020).
- Barochia, A., Solomon, S., Cui, X., Natanson, C. & Eichacker, P. Q. Eritoran tetrasodium (E5564) treatment for sepsis: review of preclinical and clinical studies. Expert Opin Drug Metab Toxicol 7, 479-494, doi:10.1517/17425255.2011.558190 (2011).
- Croxtall, J. D. & Perry, C. M. Lopinavir/Ritonavir: a review of its use in the management of HIV-1 infection. Drugs 70, 1885-1915, doi:10.2165/11204950-000000000-00000 (2010).
- Ruiz-Irastorza, G., Martín-Iglesias, D. & Soto-Peleteiro, A. Update on antimalarials and systemic lupus erythematosus. Curr Opin Rheumatol 32, 572-582, doi:10.1097/bor.0000000000000743 (2020).
- Azithromycin for community treatment of suspected COVID-19 in people at increased risk of an adverse clinical course in the UK (PRINCIPLE): a randomised, controlled, open-label, adaptive platform trial. Lancet 397, 1063-1074, doi:10.1016/s0140-6736(21)00461-x (2021).
- Hoffmann, M. et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 181, 271-280.e278, doi:10.1016/j.cell.2020.02.052 (2020).
- Yamamoto, M. et al. The Anticoagulant Nafamostat Potently Inhibits SARS-CoV-2 S Protein-Mediated Fusion in a Cell Fusion Assay System and Viral Infection In Vitro in a Cell-Type-Dependent Manner. Viruses 12, doi:10.3390/v12060629 (2020).
- Matsuyama, S. et al. The Inhaled Steroid Ciclesonide Blocks SARS-CoV-2 RNA Replication by Targeting the Viral Replication-Transcription Complex in Cultured Cells. J Virol 95, doi:10.1128/jvi.01648-20 (2020).
- Burger, J. A. Bruton Tyrosine Kinase Inhibitors: Present and Future. Cancer J 25, 386-393, doi:10.1097/ppo.0000000000000412 (2019).
- Roschewski, M. et al. Inhibition of Bruton tyrosine kinase in patients with severe COVID-19. Sci Immunol 5, doi:10.1126/sciimmunol.abd0110 (2020).