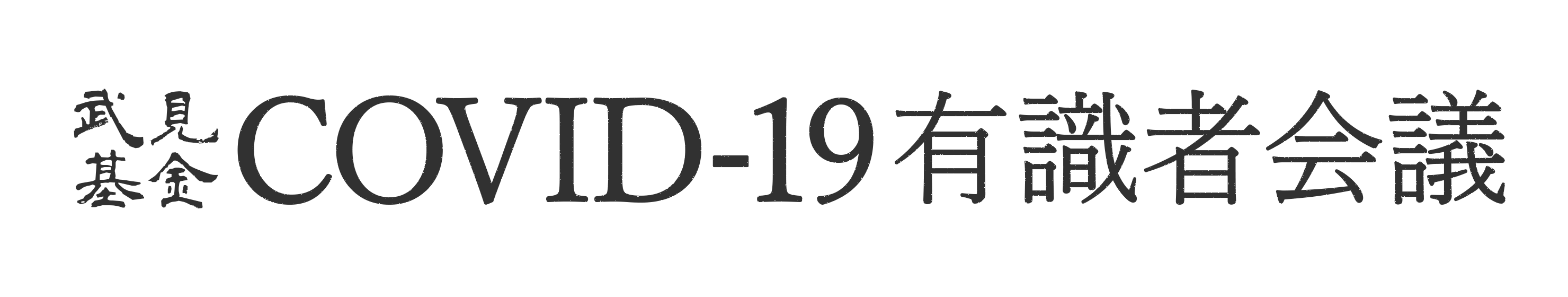- 当初、気道感染にともなう急性呼吸障害のみがクローズアップされていたCOVID-19であるが、ほどなくして多彩な血栓症の合併が高頻度にみられ、注目されるようになった。
- ICU入室例の約2割に肺塞栓がみられる。また脳梗塞が、若年者や基礎疾患のない無症候例でも発症し得る。これは、従来われわれが経験したことのないウイルス感染の合併症である。医学界はもとより、社会的な関心も高まっており、その病態解明と対処法の立案が急務である。
- 国際血栓止血学会(ISTH)は、COVID-19における凝固異常対応の暫定ガイダンスを発表した。そのなかで、D-dimerによるモニタリングと低分子量ヘパリンを用いた予防の重要性がアピールされている。
- COVID-19における凝固異常は、ウイルス感染による血管障害によって生ずると考えられる。血管内皮の抗血栓性低下とともに、von Willebrand factorや凝固第VIII因子の放出、補体の活性化やフィブリノゲンの増加、さらにサイトカインストームなどの炎症に関連する要因が複雑に絡み合い、動脈、静脈、毛細血管系のいずれにおいても血栓が生じ得る状態となる。COVID-19に伴う凝固異常は、既存の血栓症のいずれにも当てはまらないユニークな病態であり、その全容の解明は容易ではないと推測される。
COVID-19における多彩な血栓形成
COVID-19では動脈、静脈、毛細血管系のいずれにおいても血栓が生じ得る
COVID-19における肺血栓・塞栓
COVID-19の合併症として肺塞栓症は極めて高頻度に見られ、また直接的な死亡原因ともなる重要な合併症である。Wichmannらは、連続的に実施した剖検12例における検討で、深部静脈血栓が7/12(58%)にみられ、4/12(30%)では肺塞栓が直接死因であったことを報告している [1]。
肺塞栓は深部静脈血栓の非存在下においてもみられるため、通常の肺塞栓の発症機序とは異なり、肺動脈内において直接血栓が形成される機序も考えられる。
COVID-19における脳梗塞、急性冠症候群
COVID-19では,静脈血栓とともに、動脈血栓も見られることが特徴である。さらに脳梗塞は基礎疾患のない若年者、しかもCOVID-19の症状が認められない症例においても起こることがメディアでも取り上げられ、大きな注目を集めている [2]。
動脈血栓としては、脳梗塞がもっとも多く、約5%の頻度でみられる。急性冠症候群はその半分程度と考えられている。最近は、小児において川崎病に似た血管炎様の所見を呈することも報告されており、血栓とともに血管炎との関連が考えられている。また動脈血栓は四肢末端にも見られることがあり、高度の場合は虚血壊死をきたすこともある。さらに”COVID toe”と称される、つま先の疼痛を伴う発赤を特徴とする症状との関連も考えられている。
COVID-19における微小血管内血栓
血栓が細動脈、細静脈、毛細血管などの微小循環系に生じると、重要臓器の障害をきたす。このような微小循環系の血栓形成に伴う多臓器障害は、細菌感染の際にしばしば見られる播種性血管内凝固(disseminated intravascular coagulation, DIC)に似た病態と当初は考えられた。しかし後述するように凝固異常の発生機序や検査結果は、相当異なることが認識されるようになった [3]。
微小循環系の障害は、意識の変容や腎障害をもたらすことが多い。これらはしばしば血栓性微小血管症(thrombotic microangiopathy, TMA)で見られる症状であることから、部分的に共通する発生メカニズムの存在が推定されている。
COVID-19における凝固異常・血栓形成の病態生理
COVID-19関連血栓症の背景には、過剰炎症と血管内皮細胞障害がある
呼吸器障害に始まり、短時間のうちに連続性に多彩な症状を呈するCOVID-19の全体像を、俯瞰的に捉えるのは容易ではない。しかしその根底に過剰な炎症と凝固反応が存在していることを認識すれば、おぼろげながらその姿が見えてくる [4]。
そもそも炎症は病原体侵入に対する宿主の基本的な防衛反応であり、凝固もこの防衛反応の重要な一翼を担っている。すなわち体内に侵入した病原体の拡散を防ぐためには、その周囲を血栓で固めてしまうことが有効であり、さらに血管内に侵入した病原体の拡散を防ぐためには、血管内血栓を築くことで、ルート遮断を行うことが有効である。しかしこれが過剰に起こるとDICとなり、微小循環障害による多臓器障害をきたすことになる。したがって感染症における凝固の活性化は両刃の剣ということができる。
COVID-19の主たる標的は、1) 肺胞上皮細胞、2)血管内皮細胞、3) 免疫担当細胞の3つである。肺胞上皮の炎症は呼吸障害から酸素化障害をもたらすので、それだけでも致死的な障害である。
しかし当初、われわれが想定していなかった免疫の異常活性化と血管内皮障害についても、致命的となり得る合併症を高頻度にもたらすことが明らかにされ、その対策に迫られている。すなわち血栓症や塞栓症、虚血や多臓器不全などの合併症への対応である。既知のウイルス感染症で、COVID-19に匹敵する血栓傾向をもたらす疾患を見出すことは難しく、2002〜2003年に流行した同じコロナウイルスによる重症急性呼吸器症候群(severe acute respiratory syndrome, SARS)や、2012年に報告された中東呼吸器症候群(meddle-east respiratory syndrome, MERS)では、このように顕著な病態は見られなかった。したがって凝固異常、血栓症への対応は手探りで進めていかなければならない。
COVID-19における凝固異常の発生メカニズムは既知の血栓性疾患とは異なる
エボラ出血熱やデング熱などのウイルス性疾患では、高熱とともに、DIC様の出血性凝固異常がしばしば見られる。
同じRNAウイルス感染症であるCOVID-19では、出血症状が見られることは基本的にないと考えられている。その代わりに、過凝固に起因する血栓症や多臓器不全が問題となる。この様な差異がどこから生じるのかは明らかにされていないが、COVID-19の原因ウイルスであるSARS-CoV-2は、アンギオテンシンIIのレセプターであるACE2を介して血管内皮細胞に感染することが知られている。このため感染した内皮細胞から放出される凝固因子の一つである第VIII因子と、血小板粘着を刺激するvon Willebrand factor(VWF)が、病態形成に関わると考えられる。
| 図表1 |
| 血管内皮細胞障害と凝固・血小板の活性化 |
| COVID-19では、ウイルス感染により障害された血管内皮細胞から凝固第VIII因子とvon Willebrand factor (VWF)が放出され、凝固系や血小板凝集が活性化される。 |
 |
COVID-19の患者では、第VIII因子とVWFの血中レベルが増加することが報告されている [6]。第VIII因子はトロンビンによって活性化され、活性化第IX因子とともにtenaseを形成し、活性化血小板上で凝固の著しい活性化を誘導する。
上記以外にもCOVID-19では、血液凝固や血小板凝集を加速するループスアンチコアグラントの出現や、血管内皮細胞を障害する補体の活性化が見られる。すなわち、この様な機序を共有する血栓性疾患、すなわち抗リン脂質抗体症候群やTMAとの相似性が指摘されている。
過剰なサイトカイン産生によるサイトカインストームも、血栓傾向の誘引と考えられる。これは血球貪食症候群でみられる状態であり、部分的に共通点を見いだすことができる。しかし、血液検査所見や臨床上の特性は、上記いずれの疾患とも完全には合致しない。したがってCOVID-19における過凝固状態は、特有の凝固異常と考えるべきであろう。
COVID-19における凝固異常・血栓症の管理
COVID-19における凝固異常のモニタリングには、D-dimerが推奨される
検査値から見たCOVID-19における凝固異常は以下のように特徴づけられる。
- D-dimerの上昇がみられる頻度が高い
- それ以外の一般的な凝固指標(プロトロンビン時間、活性化部分トロンボプラスチン時間、アンチトロンビン活性、など)は、変化が乏しい
- フィブリノゲンの増加が見られる
- 血小板数の減少はみられない場合が多い
D-dimer値の上昇は、予後指標となり得ると報告されている。ただし中国からの報告では、入院時にD-dimerの増加がみられたのは全症例の半数弱にとどまっており、死亡例においてもその割合は、6割程度であった[5]。脳梗塞の発症との関連においては、報告された5症例のうちD-dimerの上昇が見られたのは、3例にとどまっていた[2]。よってD-dimerの上昇が見られない場合でも、重症化や血栓症の発症を否定することはできない。
重症例においても、D-dimerの増加の程度は、細菌感染症と比較すると軽度にとどまる。例えば敗血症をベースとしたARDS症例におけるD-dimer値は5-10 μg/mL程度、DICを合併すればそれ以上に上昇するのに対し、COVID-19のARDS症例では4 μg/mL以下であることが多いとされる[6]。
以上をまとめると、D-dimerについては上昇がみられない場合にも油断はできず、また重症度指標とする際にも、顕著な上昇がみられなくても、慎重な対応を心がける必要がある。
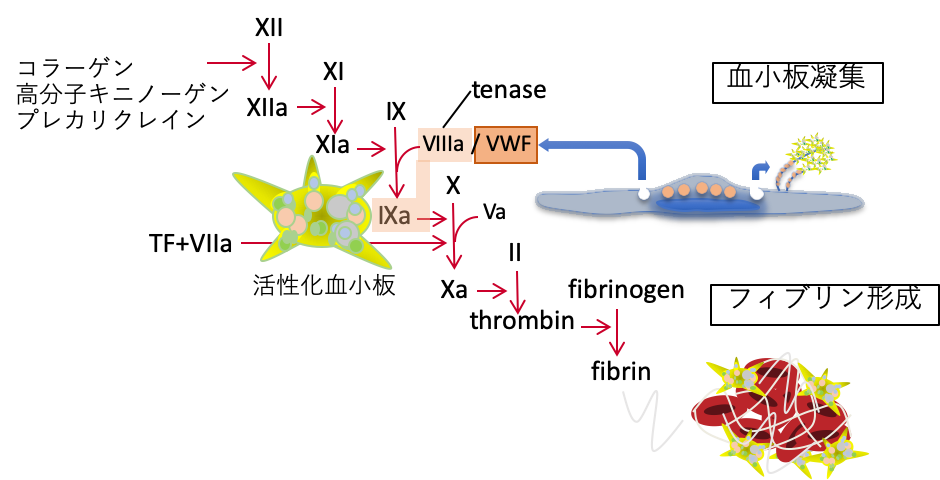
D-dimerに関しては、一般にはいわゆる血栓症のスクリーニングとして測定されることが多いが、COVID-19においては、それとともに微小血管内凝固も反映する指標と捉える必要がある。したがってD-dimer値の上昇した症例では、血栓症の存在を念頭におくとともに、多臓器障害の合併リスクも勘案して、血栓リスクが必ずしも高くないと思われても、積極的な抗凝固療法の対象とするのが妥当である。凝固異常のモニタリング法として、既存の凝固マーカー以外で期待されているのは、トロンボエラストグラフィーやトロンボエラストメトリーと呼ばれる血液の粘弾性(viscoelasticity)を調べる手法である。これによりCOVID-19においては、内因系、外因系凝固ともに高度に亢進し、線溶系が抑制されていることがわかる。近年ではpoint-of-careデバイスとして普及しつつあり、凝固異常評価における有用性が期待される。
| 図表2 |
| COVID-19における血液粘弾性の変化 |
| Viscoelastic testでは、血液の凝固・線溶機能を総合的に評価することが可能である。COVID-19では著しい凝固の亢進と線溶抑制状態が見られる。 |
 |
COVID-19関連血栓症の治療には低分子量ヘパリンが推奨されている
国際血栓止血学会(International Society on Thrombosis and Haemostasis)は、COVID-19における凝固異常・血栓症の問題をいち早く取り上げ、管理指針を提供している [7]。
概要は下記のとおりである。
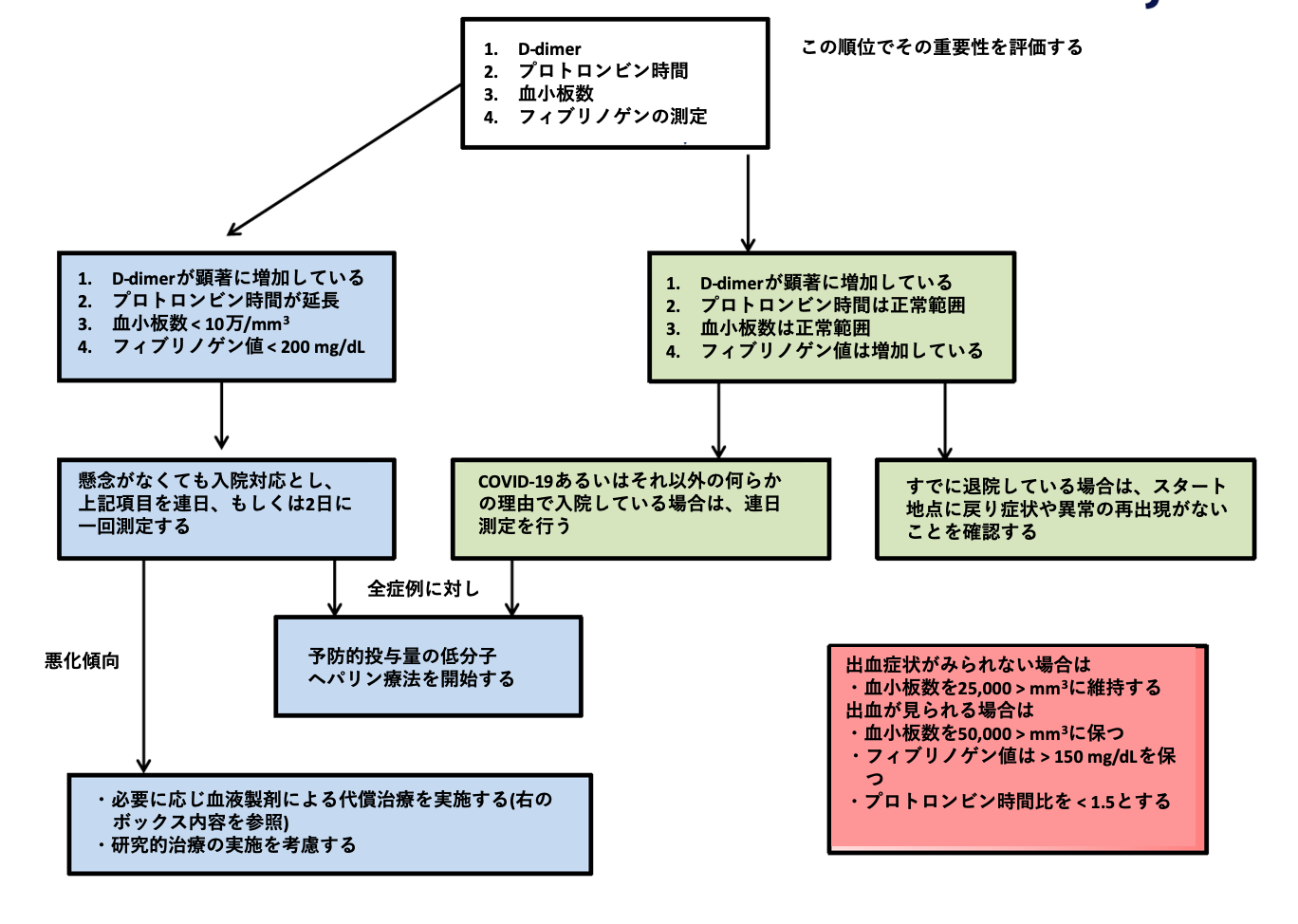
- 基本となるのが凝固検査である。D-dimerをCOVID-19の重症度指標として重視し、さらにプロトロンビン時間や血小板数はDICの並存を考えて、確認することとする。
- フィブリノゲンは血栓傾向の指標となる。これらの検査値異常が顕著であれば、【図表3】においてブルーの領域に進み、必要に応じて低分子量ヘパリンによる予防的抗凝固療法を開始する。
- 病態が悪化して非代償性の凝固不全状態となれば、補充療法を考慮する。
- 一方、状態は比較的安定しているが(【図表3】中グリーン)、D-dimer値が正常上限の3〜4倍を超えている際は、入院治療中であれば低分子量ヘパリンによる予防的抗凝固療法を開始、入院外であれば検査を繰り返し、慎重に経過観察を行う。
| 図表3 |
| 国際血栓止血学会暫定COVID-19凝固管理ガイダンス |
| COVID-19では、D-dimer、その他の凝固関連マーカーを測定し、異常のみられる際には、積極的な低分子量ヘパリンを用いた予防的抗凝固療法を実施することが推奨されている(引用文献7より改変)。 |
 |
問題となるのは、国内では低分子量ヘパリンによる血栓予防は体外循環時か、整形外科領域、もしくはハイリスクの腹部手術の周術期においてのみ保険適応が認められていることである。COVID-19対策として早急にその使用を可能とする対応が望まれる。
未分画ヘパリンに関しては、血栓治療と予防を目的とした保険適応が認められている。しかし使用にあたっては、活性化部分トロンボプラスチン時間による用量調節が必要である。また血栓症を生じるリスクの高い、ヘパリン起因性血小板減少症(heparin-induced coagulopathy, HIT)の合併にも注意が必要である。未分画ヘパリン、低分子量ヘパリン、あるいはそれ以外の血栓症治療薬については、【図表4】にまとめた。
| 図表4 |
| わが国で保険適応される各種ヘパリン製剤 |
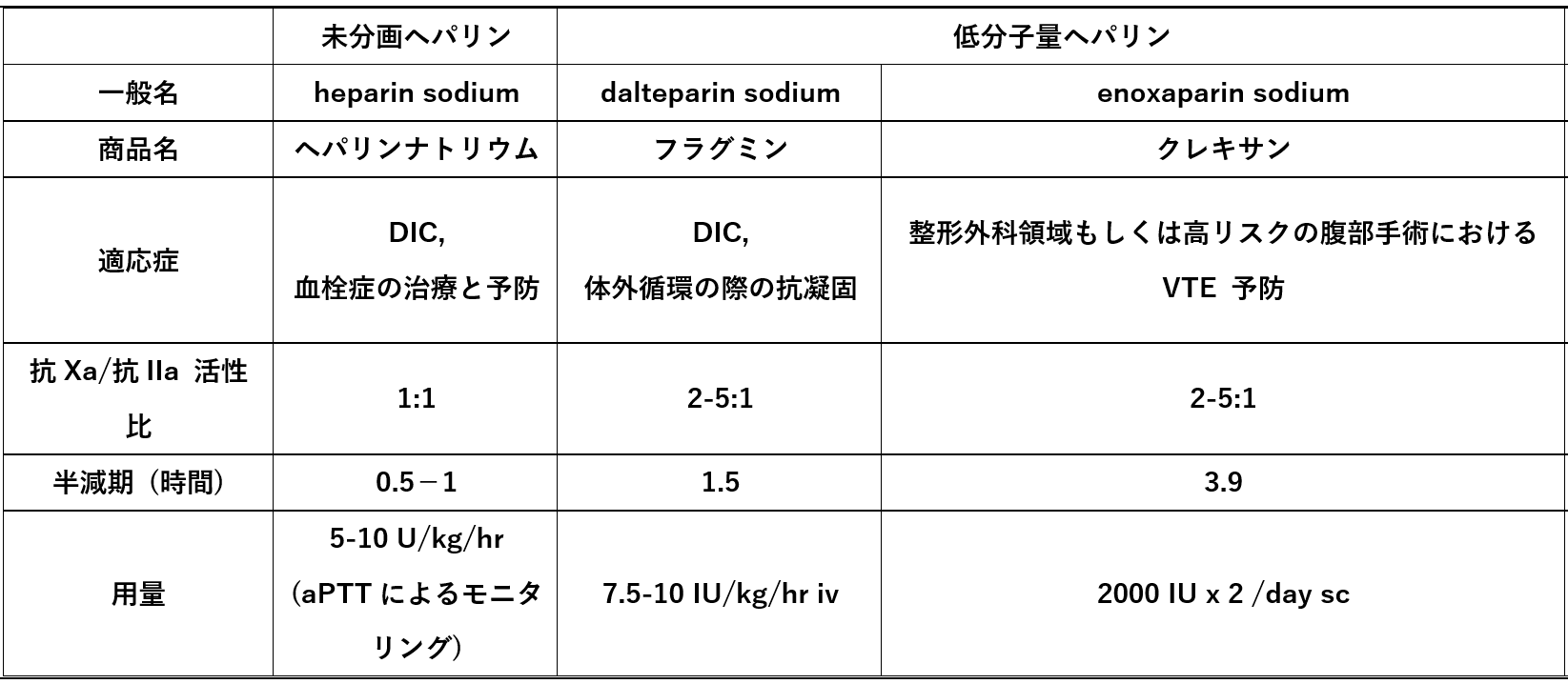 |
[引用文献]
- Ann Intern Med. 2020;10.7326/M20-2003.
- N Engl J Med. 2020;382(20):e60.
- Lancet Haematol. 2020;S2352-3026(20)30145-9.
- Intensive Care Med. 2020;1‐4. doi:10.1007/s00134-020-06088-1
- N Engl J Med. 2020;382(18):1708‐1720.
- Intensive Care Med. 2020;10.1007/s00134-020-06082-7.
- J Thromb Haemost. 2020;18(5):1023‐1026.