(2020年6月15日訂正)
・この記事は、引用した論文(オリジナルの文献18:Mehra MR et al Cardiovascular Disease, Drug Therapy, and Mortality in Covid-19. N Engl J Med. 2020)が撤回されましたので、関連する記述を削除しました。
・本稿の一部は、World Hypertension LeagueのOfficial Journal であるJournal of Hypertension誌に掲載されます(Kario K et al. COVID-19 and Hypertension – Evidence and Practical Management. Guidance from the HOPE Asia Network. J Clin Hypertens 2020 [in press])。
- 新型コロナウィルスSARS-CoV-2は細胞膜に発現するアンジオテンシン変換酵素2(ACE2)を介して標的細胞に感染する。ACE2の発現は、肺、心、血管、腎臓などにみられ、これらが標的臓器となる。
- COVID-19の最大のリスク因子は加齢である。高血圧患者はCOVID-19が重症化しやすいが、高血圧自体が加齢や他のリスク因子や臓器障害と独立して新型コロナウィルスの感染や重症化のリスクであることを直接的に示すエビデンスはない。
- COVID-19では、高血圧、糖尿病、喫煙、循環器疾患(心不全、脳卒中、狭心症、心筋梗塞)、慢性肺疾患、慢性腎臓病、悪性疾患(特に化学療法、放射線治療中)が重症化リスクとなる。
- ACE2はアンジオテンシンIIをアンジオテンシン(1-7)に変換する。アンジオテンシン(1-7)は、アンジオテンシンIIに拮抗する生物学的活性(血管拡張、炎症や血管透過性の抑制など)を有し、臓器保護にはたらくカウンターホルモンである。
- ARBとACE阻害薬には細胞膜ACE2発現を増加させることを示す実験データがあることから、コロナ感染のリスクを助長することが危惧された。一方、コロナウィルスが感染した細胞では膜表面のACE2発現が減少する。したがってACE2で処理できないアンジオテンシンIIがアンジオテンシン受容体1(AT1R)に結合し、肺障害(ARDS)や心血管障害を重症化することが危惧される。ARBとACE阻害薬は、この重症化を抑制することが期待されている。 つまり、実験成績と機序仮説の上からは、ARB やACE阻害薬はCOVID-19の病態早期において感染性を上げるが、重症化は抑制すると推定される。 しかし、これまで臨床データではACE阻害薬やARBがSARS-CoV-2の感染性や重症化のリスクを増加させるとの報告はない。したがって、現時点では、国内外の全ての学会はARB やACE阻害薬の継続投与を推奨している。
- COVID-19の死亡例は、症状の発生から死亡に至る期間はほぼ20日未満と近い。明確な呼吸器系の症状がなくても、診察時にパルスオキシメータで測定した酸素分圧SpO2の94%以下への低下が最も重要な重症化所見である。
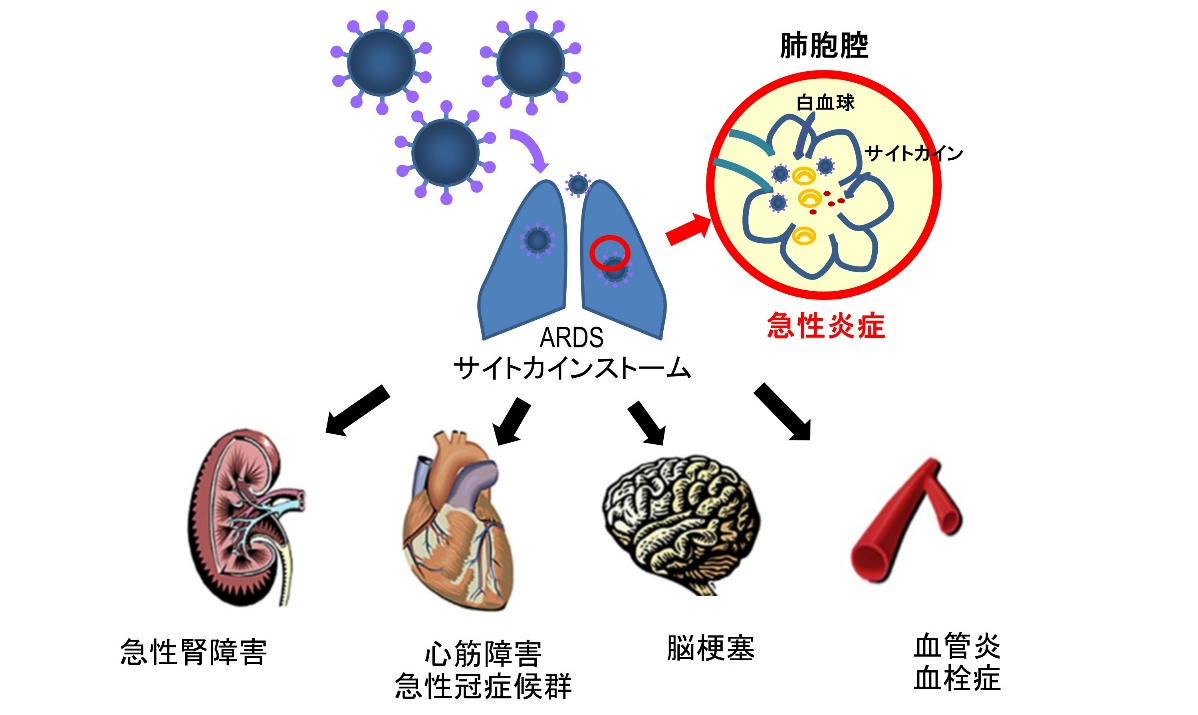
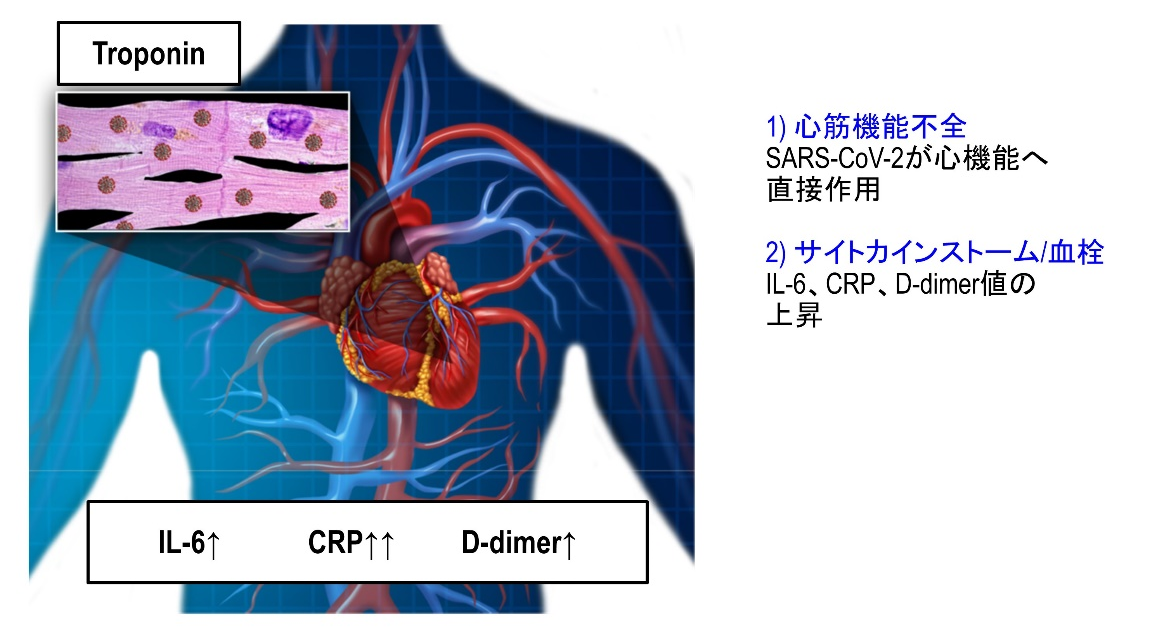
- COVID-19重症化症例では急性呼吸窮迫症候群(ARDS)に加え、心筋傷害とサイトカインストームが引き起こされ、心不全や血栓性心血管疾患、急性腎障害のリスクが増加する。その重症化バイオマーカーはトロポニン、NT-ProBNP、D-ダイマー、クレアチニンである。
- 感染に対する恐怖や自宅隔離による精神的ストレス、抑うつ状態、不眠、便秘、ならびに運動量の低下による、血圧や血糖のコントロール不良や体重の増減など、直接的な感染以外のリスクにも目を向ける。
- この強い感染力と多彩な臨床像を示すCOVID-19に対し、今まさに、患者一人一人に責任を持った現場医療機関の役割分担と行政を含む地域医療ネットワークの力が必要不可欠である。
はじめに
新型コロナウィルスSARS–CoV–2で引き起こされる新型コロナウィルス感染症(COVID-19)は、世界に瞬く間に広がり、一定の割合で重症化し、医療現場と社会生活を一変させている。 初診時は発熱で来院することが多いが、多彩な症状を示す【図表1】。軽症例では予後は良好であるが、重症例でも初期は比較的サイレントに進行するが、症状発症から急激に悪化する急性呼吸窮迫症候群(ARDS)を呈し、さらに心筋傷害や、血管障害に起因する循環器疾患、急性腎障害などを合併することが多い【図表2】。この強い感染力と多彩な臨床像を示すCOVID-19へ立ち向かうには、まさに現場の医療機関の役割分担と、行政を含む地域医療ネットワークの力が必要不可欠である。
| 図表1 |
| COVID-19の多彩な症状 |
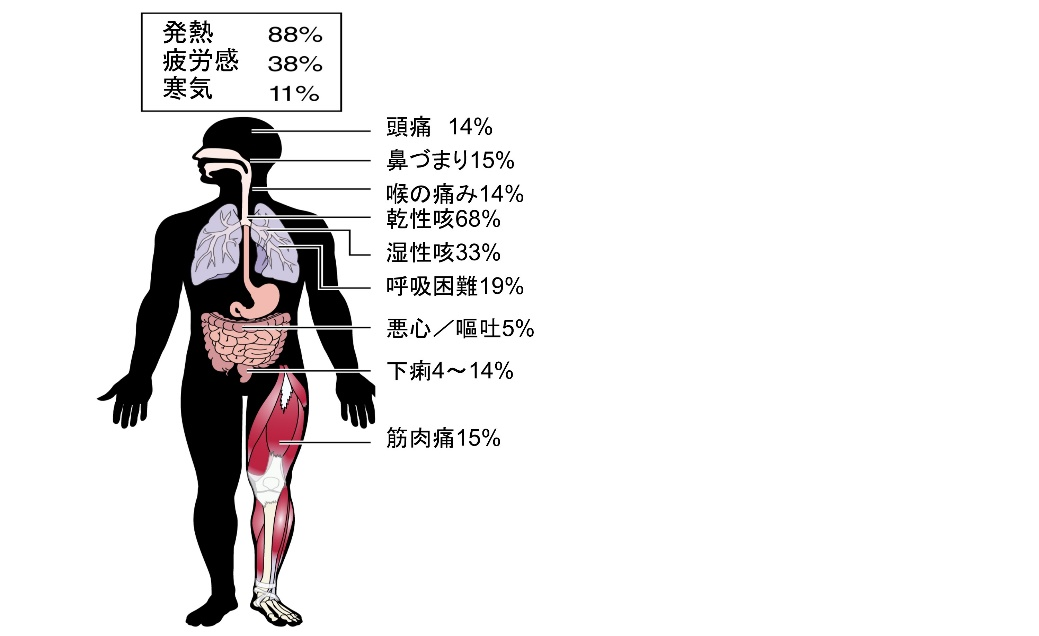 |
| Clerkin KJ, et al. COVID-19 and CVD. Circulation 2020 |
| 図表2 |
| COVID-19で引き起こされる多彩な疾患 |
 |
COVID-19は高血圧が重症化のリスク因子として早くから注目されていた。このウィルスは、細胞膜に発現しているアンジオテンシン変換酵素2(ACE2)を侵入門戸とし、ターゲット細胞へ感染する。したがって、ACE2発現に影響を与えるアンジオテンシン受容体拮抗薬(ARB)やACE阻害薬がウィルスの易感染性や重症化に影響を与える可能性が指摘されている[1-6]。
本報告では、コロナウィルス感染と高血圧に関わる最新の知見と降圧療法の要点をまとめる。
高血圧はCOVID-19のリスクか?
高血圧患者が重症化しやすいことは間違いない。しかし、高血圧自体が加齢や他のリスク因子や臓器障害とは独立してコロナウィルスの感染や重症化のリスクであるかどうかを示す直接的なエビデンスはない。
COVID-19のサージが生じたイタリアにおいて、イタリア衛生研究所が2020年3月20日にCOVID-19死亡者3200名と発表した(https://www.epicentro.iss.it/coronavirus/bollettino/Report-COVID-2019_20_marzo_eng.pdf)。死亡例では平均年齢が78.5歳(中央値80歳、範囲31-103歳)と高齢で、1つ以上の合併疾患を有する例が98.7%に及び、中でも高血圧患者は73.8%、特にARBかACE阻害薬を服用していた患者が52%にも及んだことから、高血圧、特にARB/ACE阻害薬自体がリスクになることが心配された。
しかし、重症COVID-19は高齢者に多く、高血圧を有することが多い。加齢、高血圧、糖尿病、喫煙、循環器疾患(心不全、脳卒中、狭心症、心筋梗塞)、慢性腎臓病、慢性閉塞性肺疾患がCOVID-19の重症化のリスク因子である【図表3】[7-12]。しかし、高血圧は加齢現象そのものであり、【図表3】に列挙されたリスク因子は、加齢と血管障害に関連したリスク因子である。高血圧患者ではこれらのリスク因子を伴うことが多い。したがって、COVID-19重症化のリスクは高血圧そのものよりも、高血圧に関連した血管内皮障害や臓器障害などに起因する可能性が高い。重症死亡例の血管にコロナウィルスが証明されたという直接的な報告もある[13]。
| 図表3 |
| COVID-19の重症化リスク因子 |
 |
ARB とACE阻害薬の継続に問題はないか?
2020年5月1日までに発表された臨床エビデンスでは、少なくともARB/ACE阻害薬の使用がCOVID-19の感染ならびに重症化リスクを悪化させる報告はない。アメリカ心臓病学会(AHA)、ヨーロッパ心臓病学会(ESC)、日本循環器学会(JCS)、日本高血圧学会(JSH)などの国内外の全ての学会は、ARB/ACE阻害薬の投与は、中断せずに継続することを推奨している。
1)ACE2をめぐる機序
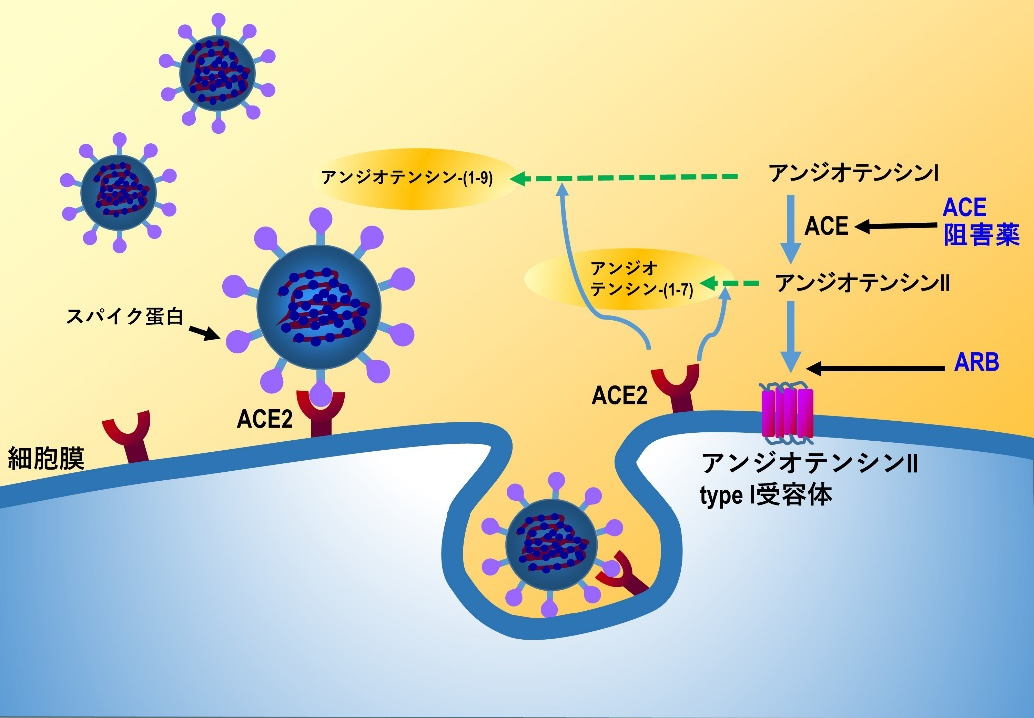
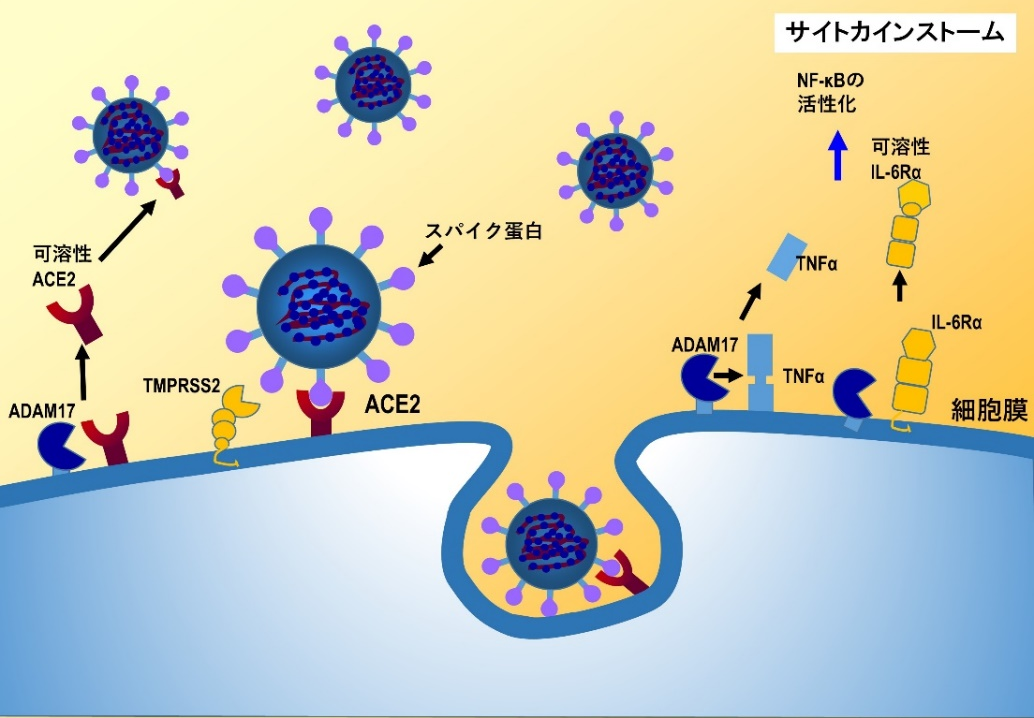
新型コロナウィルスSARS–CoV–2は、ウィルス表面にあるスパイク蛋白が、ターゲット細胞の膜表面にあるACE2に結合し、セリンプロテアーゼTMPRSS2が作用し、スパイク蛋白の一部を切断して、ウィルスのエンベロープと細胞の膜が融合することにより細胞内に侵入する[14]。したがって、ACE2の発現が多い細胞は感染しやすいことが危惧される。
実験的にはARBやACE阻害薬は、ACE2細胞膜発現を増加させることが知られており、COVID-19感染の重症化リスクになることが危惧されている。ARBが心臓と腎血管でACE2の発現をmRNAと蛋白レベルで増加させることを示す実験成績があるが、ACE阻害薬にはARBほどの明確な作用は示されていない。フサン(一般名ナファモスタット)とフオイパン(一般名カモスタット)は、セリンプロテアーゼTMPRSS2を抑制し、ウィルスの侵入を阻止することが期待されている。
ACE2はアンジオテンシンII(ATII)をアンジオテンシン(1-7)へ変換する。アンジオテンシン(1-7)は、血管弛緩作用や血管透過性の抑制や抗炎症作用など、ATIIに拮抗するカウンター作用を示し、臓器保護に働く。
ATIIはアンジオテンシン1型受容体(AT1R)を活性化し、ADAM17という細胞膜上に存在するプロテターゼを活性化する。ADAM17により細胞表面のACE2が切り離され、可溶性ACE2となる。可溶性ACE2は新型コロナウィルスSARS–CoV–2のスパイク蛋白に結合し、ウィルスの細胞膜ACE2への結合を抑制する作用が期待される。しかし、生体内で発生している可溶性ACE2の血中レベルはわずかで、細胞膜に存在するACEの数%に過ぎないことから、現在、リコンビナント可溶性ACE2製剤の臨床試験が進行している。
また、AT1R刺激で活性化されるADAM17は、細胞膜に存在する前駆体TNFαやIL-6受容体α(IL-6Rα)を切断し、TNFαや可溶性IL-6Rαを放出する。TNFαは受容体を介してNF-κBを活性化し、IL-6をはじめとする様々な炎症性サイトカイン産生を誘導し、サイトカインストームを引き起こす。したがって、ARBや抗IL-6抗体がサイトカインストームの抑制に働くことが期待されている[15]。
SARS-CoVでは感染に伴いACE2発現が低下することがすでに明らかにされている[16]。その結果、ATIIが増加するが、SARS-CoVによるARDSが、ARBやACE2リコンビナント投与により抑制されることが期待される。
2)ARB/ACE阻害薬の臨床エビデンス
2020年5月1日までに発表された6つの臨床研究では、ARBやACE阻害薬の使用がCOVID-19の感染や重症化のリスクと関連がないとするものや[17-19]、むしろ良好な予後と関連するという報告があるが[20,21]、リスクを増加させるという報告はない。
- 武漢中央病院の入院患者を検討した研究では[17]、PCRで確定診断がついたCOVID-19患者1178名(平均年齢55.5歳)の内、高血圧患者は362名(30.7%、平均年齢66歳)おり、その内、ARB/ACE阻害薬の投与を受けていた患者は115名(31.8%)であった。高血圧患者の院内死亡率は21.3%と、全患者の11.0%よりも高かったが、ARB/ACE阻害薬服用者の頻度は、重症コロナ感染患者と非重症感染患者の間(32.9% vs 30.7%; P=0.65)、死亡者と生存者の間(27.3% vs 33.0%; P=0.34)で差がなかった。また、ARBとACE阻害薬に分けた頻度も差がなかった。
- 湖北省の9病院に入院したCOVID-19患者1128名(64歳)を検討した研究では[20]、ARB/ACE阻害薬服用者188名は、非服用者940名に比較して、死亡頻度は有意に少なく(3.7% vs. 9.8%; P= 0.01)、多因子補正後もARB/ACE阻害薬服用者の死亡リスクは有意に低下していた(補正ハザード比 0.37, P=0.03)。さらに、高血圧を合併するCOVID-19患者においても、他のクラスの降圧薬服用者に比し、ARB/ACE阻害薬服用者の死亡リスクは0.30と低かった(P=0.01)。
- 武漢の湖北省病院1施設においてのレトロスペクティブ研究では[21]、1月5日から2月22日の高血圧を合併していたCOVID-19患者126名を、ARB/ACE阻害薬を投与されていた群43名とARB/ACE阻害薬以外の降圧薬を投与されていた患者83名に分けた。コントロール群とし、年齢と性別を一致させた高血圧を有さないCOVID-19患者125名を無作為に抽出した。COVID-19のアウトブレイクが生じる前の、2019年の11月1から12月31日に来院した高血圧患者1942名のカルテ情報を比較した。高血圧患者において、COVID-19の合併の有無で、ARB/ACE阻害薬の使用頻度に差はなかった。高血圧を合併していたCOVID-19患者において、ARB/ACE阻害薬とそれ以外の降圧薬で、血圧レベルに差はなかった。しかし、ARB/ACE阻害薬の使用群では、それ以外の降圧薬使用群に比し、CRP(p=0.049)とプロカルシトニンレベル(p=0.008)が有意に低く、統計的には有意ではないものの、重症例(9.3% vs 22.9%; p=0.061)と死亡率が低かった(4.7% vs 13.3%; p=0.216)。
- イタリア中北部のロンバルディア地域住民において、2月21日から[MO8] 3月11日に確認されたCOVID-19患者6272名と、年齢、性別と居住自治体を一致させた地域保健サービス受益者30,759名をコントロール群として比較した研究では[18]、COVID-19群ではコントロール群に比し、ARB/ACE阻害薬投与が多かったが、他の降圧薬や他の薬剤投与、さらに合併症も多かった。ARB/ACE阻害薬投与は、COVID-19や(補正オッズ比: ARB 0.95 [95%信頼区間CI:0.86-1.05]、ACE阻害薬0.96 [95%信頼区間 0.87-1.07])、重症化とも関連がなかった(ARB 0.83 [95%CI 0.63-1.10]; ACE阻害薬0.91 [95%CI 0.69-1.21]。したがって、この地域住民対象の研究により、ARB/ACE阻害薬がCOVID-19患者で多いのは、心血管疾患が患者群で多いことにより、ARB/ACE阻害薬はCOVID-19のリスクには影響を与えていないことが示された。
- ニューヨークの病院の電子カルテでCOVID-19のPCR検査を受けた記載のあった12,594名を対象としたデータベース研究において[19]、ACE阻害薬、ARB、β遮断薬、Ca拮抗薬、サイアザイド系利尿薬投与群において、新型コロナウィルスの罹患率(COVID-19テストが陽性か陰性かで判断)と、陽性者の中で重症化率(ICU入室、人工呼吸器使用、または死亡)に差があるかを検討した。全体群、高血圧群に分け、薬剤間をプロペンシティースコアで一致させた後、ベイズ解析を用いて予後を比較した。5894名(46.8%)がCOVID-19テスト陽性で、1002名(17.0%)が重症患者でぁつた。高血圧患者は全体群での4357名(34.6%)で、COVID-19陽性群では2573名(59.1%)、重症者は634名(24.6%)であった。降圧薬のクラスにより陽性率は差がなかった。また陽性患者において、その重症化に薬剤差はなかった。したがって、5つの降圧薬にCOVID-19罹患率と重症化に差はなかった。
| 図表4 |
| 新型コロナウィルスSARS-CoV-2とレニンアンジオテンシン系の関連(1) |
 |
| 図表5 |
| 新型コロナウィルスSARS-CoV-2とレニンアンジオテンシン系の関連(2) |
 |
COVID-19の重症化バイオマーカーは何か?
COVID-19重症化症例では急性呼吸窮迫症候群(ARDS)に加え、心筋傷害とサイトカインストームが引き起こされ、心不全や動静脈血栓症(静脈血栓塞栓症、急性冠症候群、脳梗塞)、急性腎障害のリスクが高まる。その重症化バイオマーカーはトロポニン、NT-ProBNP、D-ダイマー、クレアチニンである。
重症化バイオマーカーとして最もインパクトが強いものは心筋傷害を示すトロポニンである。他にはD-ダイマーと、IL-6が注目されている。D-ダイマーは血管傷害による動脈微小血栓、静脈血栓症(肺塞栓と深部静脈血栓症)、DICを示すバイオマーカである。IL-6は炎症指標であり、サイトカインストームのバイオマーカーである。NT-proBNPは心不全、クレアチニンは腎障害のバイオマーカーである。これらのバイオマーカーが高い場合は、重症化と考えてよい。
1)トロポニン
COVID-19では入院時初期、または病態の進行により発生する心筋傷害が予後の強いリスクになることが報告されている。特にトロポニンが感度の高いバイオマーカーである。心電図虚血所見やブロック、CPK上昇なども重要な重症化の所見である。
心血管障害の機序として、2つが考えられる。1つは心筋・血管細胞への直接的なウィルス感染と、もうひとつは全身炎症反応であるサイトカインストームである。心筋傷害は、急性冠症候群、心筋炎、ストレス(タコつぼ)心筋症、不整脈、心原性ショック、心停止などの臨床病態を反映する。
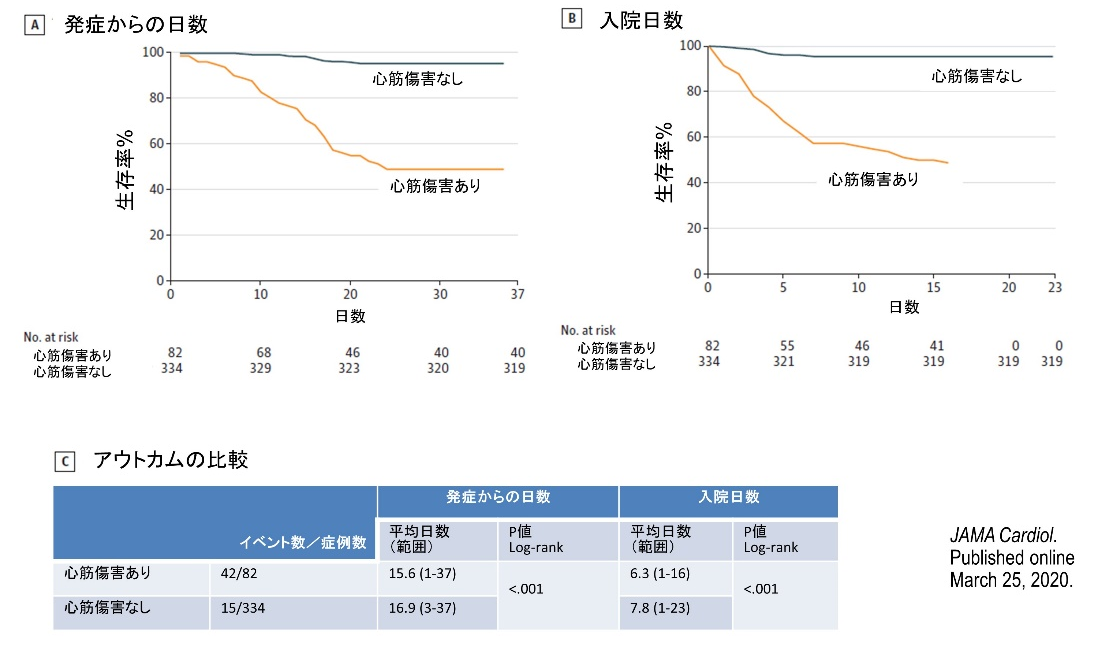
武漢大学病院に入院したCPVID-19患者(64歳)の内、心筋傷害(トロポニン99パーセンタイル以上)がみられた患者は82名(19.7%)であった[11]
心筋傷害を示す患者は、示さない患者に比較して、高齢で(74歳 vs 60歳; P<0.001)、高血圧の合併が多かった(59.8% vs 23.4%; P<0.001)。心筋傷害を示す患者は、ARDS(58.5% vs 14.7%; P<0.001)、急性腎障害(8.5% vs 0.3%; P<0.001)の発症頻度が高く、死亡率も高かった(51.2% vs 4.5%; P<0.001)。心筋傷害を示す群の症状出現後の死亡リスクは、心筋障害のない群と比較して4.26倍であった【図表6】。この心筋傷害は、心電図や心エコーによる心機能とは独立していた。
COVID-19感染患者4189名に及ぶ28研究のメタ解析でも[22]、重症患者でよりトロポニンレベルが高かった。心筋障害の重症度は高血圧患者で高く(p=0.03)、死亡リスクも高かった(リスク比3.85倍)。経過中、死亡者においてのみ、心筋傷害マーカーが増加していた。
| 図表6 |
| COVID-19の心筋傷害とバイオマーカー |
 |
| Clerkin KJ, et al. COVID-19 and CVD. Circulation 2020.改変引用 |
| 図表7 |
| COVID-19の心筋傷害バイオマーカーと予後 |
 |
| Shi S et al. JAMA Cardiol. 2020 Mar 25. doi: 10.1001/jamacardio.2020.0950. [Epub ahead of print] |
2)D–ダイマー
D-ダイマーが院内死亡の強力なリスク因子となる[23]。COVID-19では末梢動脈微小血栓や静脈血栓塞栓症の発症のリスクも増大しており、抗凝固療法も考慮する[24]。
ミラノの大学病院で入院したCOVID-19患者388名において、動静脈血栓症(静脈血栓塞栓症、急性冠症候群、DIC)の累積発生率は21%に及び、ICU入室患者では100%血栓予防を行っていたが、27.6%に血栓症が発症した[25]。この血栓症は約50%が入院24時間以内に発生している。
| 図表8 |
| COVID-19の重症化バイオマーカーと病態 |
 |
COVID–19リスクにある高血圧患者の診療
【図表9】に2020年5月5日までに発表されたエビデンスに基づき、私見を加えてCOVID-19リスクにある高血圧診療の要点をまとめた。
| 図表9 |
| 2020年5月5日までのエビデンスを考慮したCOVID-19リスクにある高血圧診療の要点 |
 |
加齢がCOVID-19の感染と重症化の最大のリスク因子である。高血圧は加齢とともに増加し、糖尿病や治療中のがんなど免疫力が低下した患者、心不全や動脈硬化性循環器疾患、さらに喫煙歴や慢性肺疾患、さらに、腎臓病患者などと共に、COVID-19感染の重症化と死亡リスクを高める。
COVID-19のリスクは、直接の感染リスクだけではない。恐怖による精神的ストレスや行動制限による運動量低下により、循環器疾患の発症リスクが増加している。
特に循環器疾患などを合併する高血圧患者では、食事や運動、さらに睡眠、室温調節など生活習慣を整え、従来の抗血栓薬や抗凝固薬は必ず継続し、体重と血圧コントロールを徹底しておくことが重要である。
糖尿病を合併する患者では、コロナ対策による運動量の低下で、確実に血糖コントロールは悪くなる。血糖コントロールの不良はCOVID-19の重症化の明確なリスク因子であることから、より綿密な血糖管理が必要である[26]。
ARBやACE阻害薬を投与中の患者では、継続して問題はない。ARBやACE阻害薬は心不全患者の生命予後の改善や、蛋白尿患者の腎保護効果に明確なエビデンスがある。したがって、新規高血圧患者の降圧薬の選択は、心不全や蛋白尿の合併例ではARBやACE阻害薬が望ましい。一方、合併症のない高齢者高血圧患者ではカルシウム拮抗薬が適している。患者が不幸にしてCOVID-19に感染した場合でも、血圧低下と急性腎障害に注意しながらARBやACE阻害薬を継続する。
毎日の検温に加え、家庭血圧の測定を推奨する。37.5度以上の発熱継続、労作時の呼吸困難感、家庭血圧135mmHg以上への増加または100mmHg未満への低下、持続した家庭心拍数(平均値)の10 bpm以上の増加は注意を要する。
診察時には酸素分圧の低下を最優先し、明確な呼吸器症状がなくても、パルスオキシメータで酸素分圧94%以下では重症化を考える。バイオマーカーではトロポニンとD-ダイマーを重要視する。
COVID-19患者の治療経過では、肺炎やARDSのみならず、心筋梗塞や狭心症などの急性冠症候群、脳梗塞、肺塞栓・深部静脈血栓症、末梢循環不全などの動静脈血栓症や、心筋炎、心不全、急性腎障害に注意する。
おわりに
5月5日までに発表されたCOVID-19に関する最新情報に、私見も加えて高血圧実地診療の要点をまとめた。連休明けからの診療に活かしていただければ幸いである。
また、日本高血圧学会から、一般及び患者さん向け「日本高血圧学会がおくるあなたのための新型コロナウィルス対策」シリーズが配信されている。また、シドニーオリンピック代表の萩原智子さんが自宅での運動を指導している一般の方向けの動画4本が公開された。健康維持に活用されることをお薦めする。
【YouTube】「日本高血圧学会がおくるあなたのための新型コロナウイルス対策」
【YouTube】自宅でもできる簡単体操
謝辞
連休中にもかかわらず、最新情報の収集と図表の作成に尽力いただいた自治医科大学循環器内科の学術編集コーディネータ大倉綾子氏と学術担当コーディネータの鈴木友貴子氏に深謝いたします。
その他の主要な参考文献・ガイドライン
[引用文献]
- Kai H, Kai M. Interactions of coronaviruses with ACE2, angiotensin II, and RAS inhibitors-lessons from available evidence and insights into COVID-19. Hypertens Res. 2020.
- Kreutz R, Algharably EAE, Azizi M, Dobrowolski P, Guzik T, Januszewicz A, Persu A, Prejbisz A, Riemer TG, Wang JG, Burnier M. Hypertension, the renin-angiotensin system, and the risk of lower respiratory tract infections and lung injury: implications for COVID-19. Cardiovasc Res. 2020.
- Danser AHJ, Epstein M, Batlle D. Renin-Angiotensin System Blockers and the COVID-19 Pandemic: At Present There Is No Evidence to Abandon Renin-Angiotensin System Blockers. Hypertension. 2020: Hypertensionaha12015082.
- Kuster GM, Pfister O, Burkard T, Zhou Q, Twerenbold R, Haaf P, Widmer AF, Osswald S. SARS-CoV2: should inhibitors of the renin-angiotensin system be withdrawn in patients with COVID-19? Eur Heart J. 2020.
- Sugimoto T, Mizuno A, Kishi T, Ito N, Matsumoto C, Fukuda M, Kagiyama N, Shibata T, Ohmori T, Oishi S, Fuse J, Kida K, Kawai F, Ishida M, Sanada S, Komuro I, Node K. Coronavirus Disease 2019 (COVID-19) Information for Cardiologists- Systematic Literature Review and Additional Analysis. Circ J. 2020.
- Vaduganathan M, Vardeny O, Michel T, McMurray JJV, Pfeffer MA, Solomon SD. Renin-Angiotensin-Aldosterone System Inhibitors in Patients with Covid-19. N Engl J Med. 2020; 382: 1653-9.
- Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, Huang H, Zhang L, Zhou X, Du C, Zhang Y, Song J, Wang S, Chao Y, Yang Z, Xu J, Zhou X, Chen D, Xiong W, Xu L, Zhou F, Jiang J, Bai C, Zheng J, Song Y. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, Xiang J, Wang Y, Song B, Gu X, Guan L, Wei Y, Li H, Wu X, Xu J, Tu S, Zhang Y, Chen H, Cao B. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020; 395: 1054-62.
- Guzik TJ, Mohiddin SA, Dimarco A, Patel V, Savvatis K, Marelli-Berg FM, Madhur MS, Tomaszewski M, Maffia P, D’Acquisto F, Nicklin SA, Marian AJ, Nosalski R, Murray EC, Guzik B, Berry C, Touyz RM, Kreutz R, Wang DW, Bhella D, Sagliocco O, Crea F, Thomson EC, McInnes IB. COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options. Cardiovasc Res. 2020.
- Guo T, Fan Y, Chen M, Wu X, Zhang L, He T, Wang H, Wan J, Wang X, Lu Z. Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020.
- Shi S, Qin M, Shen B, Cai Y, Liu T, Yang F, Gong W, Liu X, Liang J, Zhao Q, Huang H, Yang B, Huang C. Association of Cardiac Injury With Mortality in Hospitalized Patients With COVID-19 in Wuhan, China. JAMA Cardiol. 2020.
- Clerkin KJ, Fried JA, Raikhelkar J, Sayer G, Griffin JM, Masoumi A, Jain SS, Burkhoff D, Kumaraiah D, Rabbani L, Schwartz A, Uriel N. Coronavirus Disease 2019 (COVID-19) and Cardiovascular Disease. Circulation. 2020.
- Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, Mehra MR, Schuepbach RA, Ruschitzka F, Moch H. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020.
- Walls AC, Park YJ, Tortorici MA, Wall A, McGuire AT, Veesler D. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell. 2020; 181: 281-92.e6.
- Hirano T, Murakami M. COVID-19: A New Virus, but a Familiar Receptor and Cytokine Release Syndrome. Immunity. 2020.
- Kuba K, Imai Y, Rao S, Gao H, Guo F, Guan B, Huan Y, Yang P, Zhang Y, Deng W, Bao L, Zhang B, Liu G, Wang Z, Chappell M, Liu Y, Zheng D, Leibbrandt A, Wada T, Slutsky AS, Liu D, Qin C, Jiang C, Penninger JM. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat Med. 2005; 11: 875-9.
- Li J, Wang X, Chen J, Zhang H, Deng A. Association of Renin-Angiotensin System Inhibitors With Severity or Risk of Death in Patients With Hypertension Hospitalized for Coronavirus Disease 2019 (COVID-19) Infection in Wuhan, China. JAMA Cardiol. 2020.
- Mancia G, Rea F, Ludergnani M, Apolone G, Corrao G. Renin-Angiotensin-Aldosterone System Blockers and the Risk of Covid-19. N Engl J Med. 2020.
- Reynolds HR, Adhikari S, Pulgarin C, Troxel AB, Iturrate E, Johnson SB, Hausvater A, Newman JD, Berger JS, Bangalore S, Katz SD, Fishman GI, Kunichoff D, Chen Y, Ogedegbe G, Hochman JS. Renin-Angiotensin-Aldosterone System Inhibitors and Risk of Covid-19. N Engl J Med. 2020.
- Zhang P, Zhu L, Cai J, Lei F, Qin JJ, Xie J, Liu YM, Zhao YC, Huang X, Lin L, Xia M, Chen MM, Cheng X, Zhang X, Guo D, Peng Y, Ji YX, Chen J, She ZG, Wang Y, Xu Q, Tan R, Wang H, Lin J, Luo P, Fu S, Cai H, Ye P, Xiao B, Mao W, Liu L, Yan Y, Liu M, Chen M, Zhang XJ, Wang X, Touyz RM, Xia J, Zhang BH, Huang X, Yuan Y, Rohit L, Liu PP, Li H. Association of Inpatient Use of Angiotensin Converting Enzyme Inhibitors and Angiotensin II Receptor Blockers with Mortality Among Patients With Hypertension Hospitalized With COVID-19. Circ Res. 2020.
- Yang G, Tan Z, Zhou L, Yang M, Peng L, Liu J, Cai J, Yang R, Han J, Huang Y, He S. Effects Of ARBs And ACEIs On Virus Infection, Inflammatory Status And Clinical Outcomes In COVID-19 Patients With Hypertension: A Single Center Retrospective Study. Hypertension. 2020.
- Li JW, Han TW, Woodward M, Anderson CS, Zhou H, Chen YD, Neal B. The impact of 2019 novel coronavirus on heart injury: A systemic review and Meta-analysis. Prog Cardiovasc Dis. 2020.
- Zhang L, Yan X, Fan Q, Liu H, Liu X, Liu Z, Zhang Z. D-dimer levels on admission to predict in-hospital mortality in patients with Covid-19. J Thromb Haemost. 2020.
- Zhai Z, Li C, Chen Y, Gerotziafas G, Zhang Z, Wan J, Liu P, Elalamy I, Wang C. Prevention and Treatment of Venous Thromboembolism Associated with Coronavirus Disease 2019 Infection: A Consensus Statement before Guidelines. Thromb Haemost. 2020.
- Lodigiani C, Iapichino G, Carenzo L, Cecconi M, Ferrazzi P, Sebastian T, Kucher N, Studt JD, Sacco C, Alexia B, Sandri MT, Barco S. Venous and arterial thromboembolic complications in COVID-19 patients admitted to an academic hospital in Milan, Italy. Thromb Res. 2020; 191: 9-14.
- Kaiser UB, Mirmira RG, Stewart PM. Our Response to COVID-19 as Endocrinologists and Diabetologists. J Clin Endocrinol Metab. 2020; 105.